Презентация на тему: Фосфор Соединения фосфора

Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора….. аллотропных модификаций а) двеб) три в) четыре г) пять в) четыре – белый, черный, красный, фиолетовый 3. В атоме фосфора неспаренных электронов -… а) три б) четыре в) пять а) три 4. В реакции…. Фосфор проявляет восстановительные свойства а)4Р+5О2=2Р2О5б)2Р+3Mg=Mg3P2в)2Р+3Н2=2РН3 а)4Р+5О2=2Р2О5

Тест 5. Причина свечения белого фосфора…. а)изменение агрегатного состояния вещества б) химическое явление в) физическое явление б) химическое явление 6.Как называются соединения фосфора с металлами а) сульфаты б)фосфаты в) фосфиды в) фосфиды 7.Какой тип связи в молекуле фосфина РН3 а) ковалентная неполярная б) ковалентная полярная в) ионная а) ковалентная неполярная 8) Красный или белый фосфор ядовит? а) красный б) белый б) белый 9) Очень ядовит, с неприятным запахом, легко воспламеняется на воздухе, образует болотные блуждающие огни. О каком газе идет речь? О фосфине РН3

Фосфор Соединения фосфора химия 9 класс

План Оксид фосфора - Р2О5 Фосфорная кислота - Н3РО4 Соли фосфорной кислоты – Са3 (РО4)3 Са(Н2РО4)2 СаНРО4

Фосфор в природе В природе фосфор в свободном виде не встречается – только в виде соединений. Важнейшими природными соединениями фосфора являются минералы фосфориты и апатиты. Основную их массу составляет фосфат кальция Са3 (РО4)3, из которого и получают в промышленности фосфор.

Кислотный оксид Р2О5Физические свойства Белое гигроскопичное порошкообразное вещество. Хорошо растворимое в воде, образует несколько кислот. Используется как осушитель газов и жидкостей, отнимает воду у химических соединений.

Кислотный оксид Р2О5Химические свойства 1) с водой Р2О5 + 3 Н2О = 2Н3РО4 (ортофосфорная кислота) Р2О5 + Н2О = 2НРО3 (метафосфорная кислота) Р2О5 + 2 Н2О = Н4Р2О7 (пирофосфорная кислота)

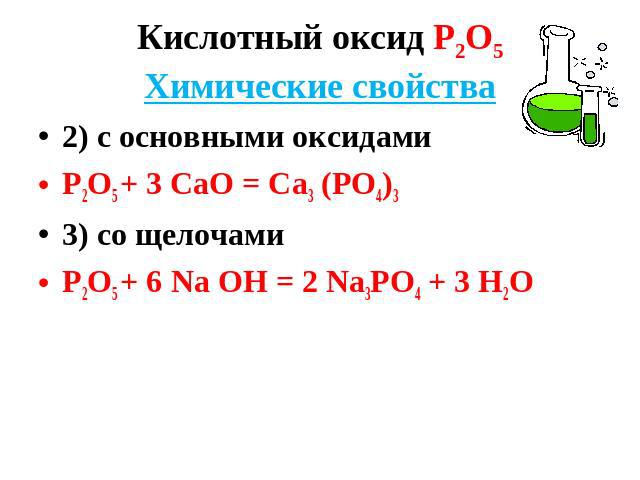
Кислотный оксид Р2О5Химические свойства 2) с основными оксидами Р2О5 + 3 СаО = Са3 (РО4)3 3) со щелочами Р2О5 + 6 Nа ОН = 2 Nа3РО4 + 3 Н2О

Ортофосфорная кислота Н3РО4Физические свойства Белые прозрачные кристаллы, не ядовита Кислота средней силы С водой смешивается в любых соотношениях. Тплав. = 42 0С, плавиться без разложения, при умеренном нагревании разлагается. Окислительные свойства не проявляет (отличие от Н2SO4 (конц.), НNO3)

Ортофосфорная кислота Н3РО4 Является трехосновной кислотой и образует три ряда солей: 1) средние соли, или фосфаты - Са3 (РО4)3 Которые нерастворимы в воде, кроме фосфатов щелочных металлов 2) Кислые-дигидрофосфаты- Са(Н2РО4)2 Большинство из которых хорошо растворимы в воде

Ортофосфорная кислота Н3РО4 3) Кислые-гидрофосфаты- СаНРО4 Которые малорастворимы в воде (кроме фосфатов натрия, калия и аммония), т.е. занимают промежуточное положение между фосфатами и дигидрофосфатами по растворимости. Вывод: с увеличением содержания атомов водорода в молекуле соли, ее растворимость повышается.

Ортофосфорная кислота Н3РО4 Химические свойства Н3РО4 проявляет все свойства кислот Реагирует: 1) со щелочами: NaOH, КОН 2) с основными оксидами: Li2O, Na2O 3) c солями: К2СО3 4) с металлами не реагирует !!! ? (см.Таблицу растворимости)

Ортофосфорная кислота Н3РО4 Химические свойства Фосфаты всех металлов (КромеЩМе) нерастворимы, поэтому на поверхности этих металлов образуется нерастворимая пленка, препятствующая их дальнейшему растворению в кислоте. ЩМе при растворении в кислоте, начинают взаимодействовать с водой.

Ортофосфорная кислота Н3РО4 Химические свойства Некоторые реакции с металлами протекают в очень разбавленных растворах: 2 Н3РО4 (разб) + 3 Мg = Мg3(РО4 )2↓ + 3Н2↑

Качественная реакция на фосфат-ион РО43- РО43- + 3 Ag+ = Ag3РО4 ↓ (желтый фосфат серебра) Полученный осадок растворяется в сильных кислотах. По этому признаку его можно отличить от других нерастворимых солей серебра желтого цвета – AgI, AgBr AgCl – белого цвета

Задание Напишите уравнение диссоциации солей Фосфата натрия Гидрофосфата натрия Дигидрофосфата натрия Обратите внимание: средние соли диссоциируют в 1 ступень (сильные электролиты), у кислых солей – несколько ступеней диссоциации.

Диссоциация солей фосфора Вывод: Каждая последующая ступень диссоциации протекает в меньшей степени, чем предыдущая.

Источники Горковенко М.Ю. Поурочные разработки по химии: 9 класс. – М.: ВАКО, 2010. – 368 с. – (В помощь школьному учителю). Габриелян О.С. Химия. 9 класс: учеб. Для общеобразоват.учреждений/О.С.Габриелян. – 17-е изд.Б стереотип. –М.: Дрофа, 2010 – 270 с.:ил.

Автор: Калитина Тамара Михайловна Место работы: МБОУ СОШ №3 с.Александров-Гай Саратовской области Должность: учитель химии, биологии, экологии. Дополнительные сведения: сайт http://kalitina.okis.ru/ Мини-сайт http://www.nsportal.ru/kalitina-tamara-mikhailovna