Презентация на тему: Соединения серы

Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения 900igr.net
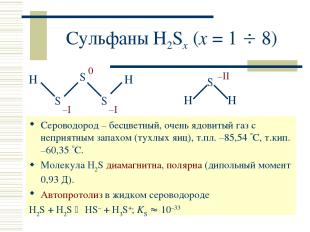
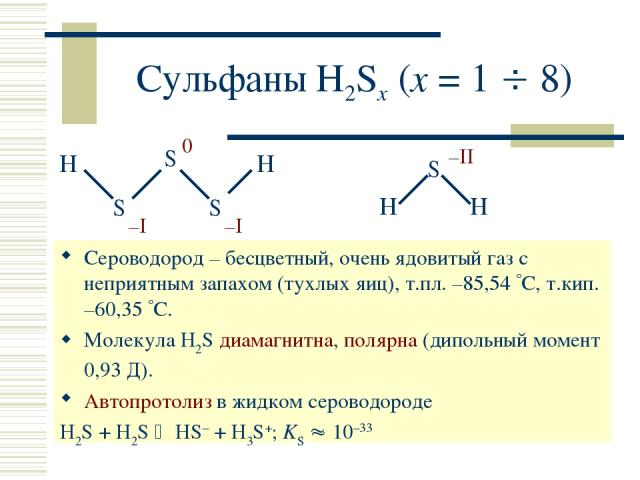
Сульфаны H2Sx (x = 1 8) Сероводород – бесцветный, очень ядовитый газ с неприятным запахом (тухлых яиц), т.пл. –85,54 С, т.кип. –60,35 С. Молекула H2S диамагнитна, полярна (дипольный момент 0,93 Д). Автопротолиз в жидком сероводороде H2S + H2S HS– + H3S+; KS 10–33

Водный раствор H2S (0,1 моль/л) H2S + H2O HS– + H3O+; KK1 = 1,05 · 10 7 HS– + H2O S2– + H3O+; KK2 = 1,23 · 10 13 [H3O+] = [HS–] = KK1·c0 [S2–] 1,23 · 10 13 моль/л при добавлении HCl (1 моль/л) концентрация [S2–] в сероводородной воде снижается до 1 · 10 21 моль/л

Сульфиды Растворимые в воде (катионы щелочных, щёлочноземельных элементов, аммония): Na2S = 2Na+ + S2–; S2– + H2O HS– + OH– Бинарные (ковалентные): Al2S3 + 6H2O = 2Al(OH)3 + 3H2S SiS2 + 4H2O = H4SiO4 + 2H2S 3. Малорастворимые (см. далее)
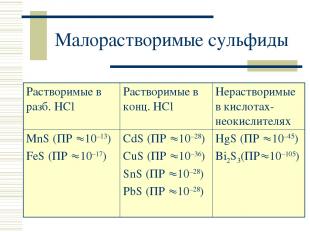
Малорастворимые сульфиды Растворимые в разб. HCl Растворимые в конц. HCl Нерастворимые в кислотах-неокислителях MnS (ПР 10–13) FeS (ПР 10–17) CdS (ПР 10–28) CuS (ПР 10–36) SnS (ПР 10–28) PbS (ПР 10–28) HgS (ПР 10–45) Bi2S3(ПР 10–105)

Расчет концентрации сульфид-иона в растворе H2S (0,1 моль/л) 1. H2S + H2O HS– + H3O+ KK1 = 1,05 · 10 7 2. HS– + H2O S2– + H3O+ KK2 = 1,23 · 10 13 K K2= [S2–] [H3O+] [HS–] [...]: С0 x x x [...]: x y y y + x = y (y + x) (x y) = y y = [S2–] K K2 =1,23 · 10 13 моль/л x >> y
![Найдем [S2–] в р-ре: H2S (0,1 моль/л) + HCl (1 моль/л) 1. H2S + H2O HS– + H3O+ K Найдем [S2–] в р-ре: H2S (0,1 моль/л) + HCl (1 моль/л) 1. H2S + H2O HS– + H3O+ K](https://fs3.ppt4web.ru/images/132073/183932/310/img6.jpg)
Найдем [S2–] в р-ре: H2S (0,1 моль/л) + HCl (1 моль/л) 1. H2S + H2O HS– + H3O+ KK1 = 1,05 · 10 7 2. HS– + H2O S2– + H3O+ KK2 = 1,23 · 10 13 K K2= [S2–] [H3O+] [HS–] [...]: С0 x x x + C1 [...]: x y y y + x + C1 = 3. HCl + H2O = Cl– + H3O+ C1 C1 C1 x >> y; C1 >> x; C0 >> x y (y + x + C1) (x y) K K1= [HS–] [H3O+] [H2S] = x (x + C1) (C0 x)
![Условия осаждения: С(М2+) С(S2 ) ПР (MS) y = [S2–] 1,29 · 10 21 моль/л В кислотн Условия осаждения: С(М2+) С(S2 ) ПР (MS) y = [S2–] 1,29 · 10 21 моль/л В кислотн](https://fs3.ppt4web.ru/images/132073/183932/310/img7.jpg)
Условия осаждения: С(М2+) С(S2 ) ПР (MS) y = [S2–] 1,29 · 10 21 моль/л В кислотной среде не осаждаются MnS (ПР 10–13), FeS (ПР 10–17) В кислотной среде осаждаются CdS (ПР 10–28), CuS (ПР 10–36), SnS (ПР 10–28), PbS (ПР 10–28) и др.

Восстановительные свойства H2S –2e = S + 2H+ ; = +0,14 В (рН 7) HS + OH –2e = S + H2O; = –0,48 В S2 2e = S; = –0,44В (рН 7) H2S + I2 = 2HI + S H2S + 4Cl2 + 4H2O = 8HCl + H2SO4 2H2S (изб.) + O2 = 2H2O + 2S 2H2S + 3 O2 (изб.) = 2H2O + 2SO2

Получение В промышленности: H2 + S H2S В лаборатории: FeS + 2HCl= FeCl2 + H2S Полисульфиды: Na2S + (x–1)S = Na2Sx Na2Sx + 2HCl = H2Sx + 2NaCl (при охлаждении) Na2Sn + 2HCl = 2NaCl + H2S + (n–1)S (при комн. т-ре) Окислительные св-ва полисульфидов Na2S2–I + Sn+IIS(т) = Na2[Sn+IVS3–II]
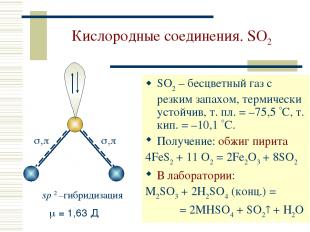
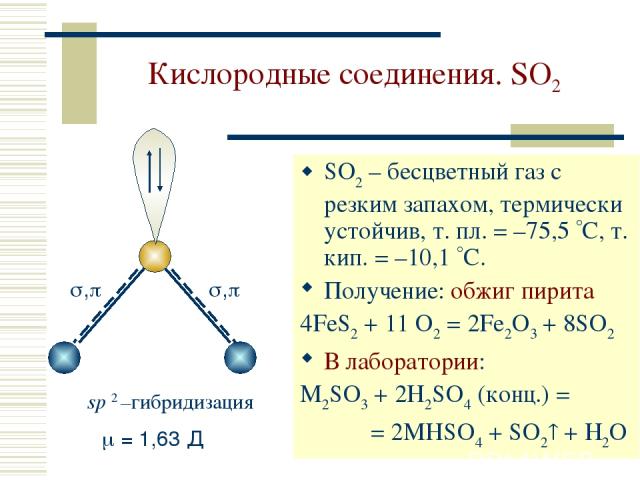
Кислородные соединения. SO2 SO2 – бесцветный газ с резким запахом, термически устойчив, т. пл. = –75,5 С, т. кип. = –10,1 С. Получение: обжиг пирита 4FeS2 + 11 O2 = 2Fe2O3 + 8SO2 В лаборатории: M2SO3 + 2H2SO4 (конц.) = = 2MHSO4 + SO2 + H2O sp 2 –гибридизация = 1,63 Д

В водном растворе: SO2 + nH2O SO2 · nH2O (n = 1 7) SO2 . nH2O + H2O HSO3 + H3O+ + (n–1)H2O; KK = 1,66·10 2 HSO3 + H2O SO32 + H3O+ ; KK = 6,31·10 8 2NaOH (избыток) + SO2 = Na2SO3 + H2O 2NaOH + 2SO2 (избыток) = 2NaHSO3

Окислительно-восстановительные свойства SO2 + 2H2S = 3S + 2H2O SO2 + 2H2O + 4e– = S + 4OH–; = –0,7 В SO2 + 2H2O + I2 = H2SO4 + 2HI SO2 + 2H2O – 2e– = SO42– + 4H+; = +0,17 В
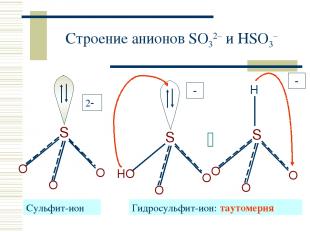
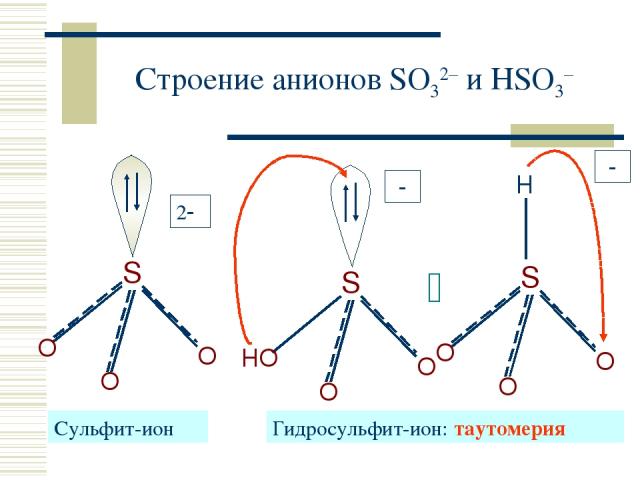
Строение анионов SO32– и HSO3– Cульфит-ион Гидросульфит-ион: таутомерия 2

Триоксид серы (SO3)x полиморфные модификации , и (т. пл. 16,8 С, 32,0 С и 62,2 С) возгоняется при нагревании Получение: 2SO2 + O2 2 SO3 (600 °C, катализатор V2O5)
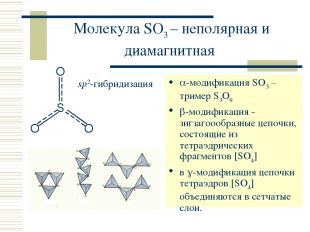
Молекула SO3 – неполярная и диамагнитная -модификация SO3 – тример S3O9 -модификация - зигзагоообразные цепочки, состоящие из тетраэдрических фрагментов [SO4] в -модификация цепочки тетраэдров [SO4] объединяются в сетчатые слои. sp2-гибридизация

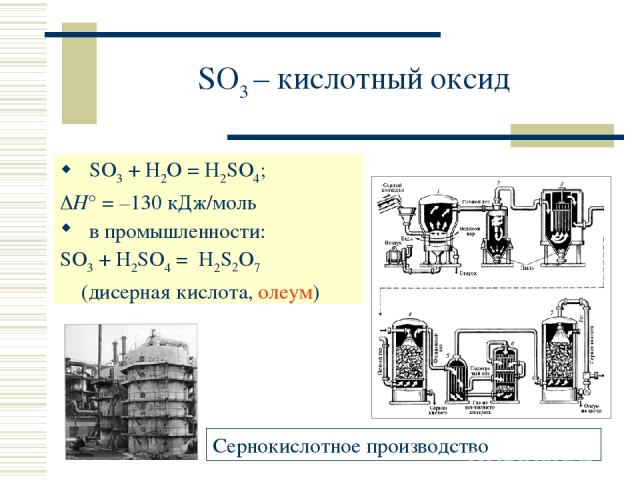
SO3 – кислотный оксид SO3 + H2O = H2SO4; H° = –130 кДж/моль в промышленности: SO3 + H2SO4 = H2S2O7 (дисерная кислота, олеум)

Серная кислота H2SO4 H2SO4 – бесцветная вязкая жидкость, плотность 1,84 г/см3, т. пл. 10,4 С. Причина аномалии свойств – водородные связи: H2SO4 ··· H2SO4 ··· H2SO4 ··· Автопротолиз: H2SO4 + H2SO4 HSO4– + H3SO4+; KS 10–4 10–5

H2SO4 в водной среде в разбавленном водном растворе H2SO4 – сильная двухосновная кислота: H2SO4 + 2H2O = SO42 + 2H3O+ в водных растворах солей-гидросульфатов рН 7 (протолиз иона HSO4 ): NaHSO4 = Na+ + HSO4 , HSO4 + H2O = SO42 + H3O+
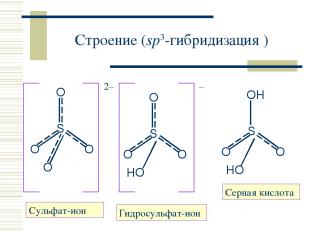
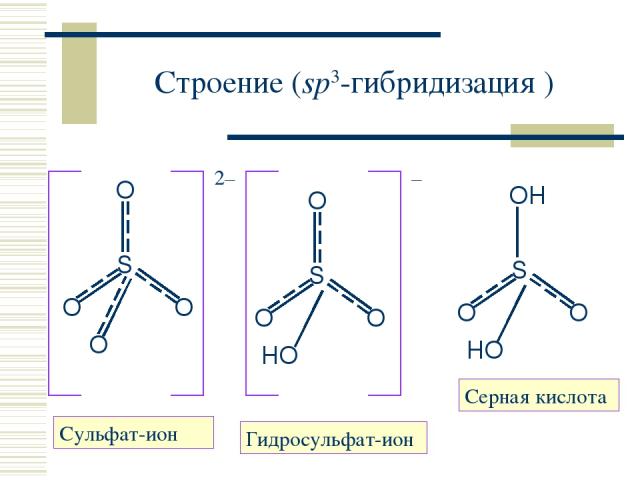
Строение (sp3-гибридизация ) Cульфат-ион Серная кислота Гидросульфат-ион

Шёниты M2IMII(SO4)2·6H2O (MI – Na, K… , MII – Mg, Zn, Co…) Купоросы MSO4·5(7)H2O (M – Cu, Fe, Ni, Mg …) Квасцы MIMIII(SO4)2·12H2O (MI – Na, K, NH4…, MIII – Al, Ga, Cr…)
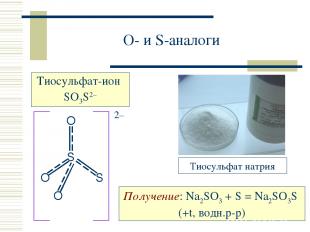
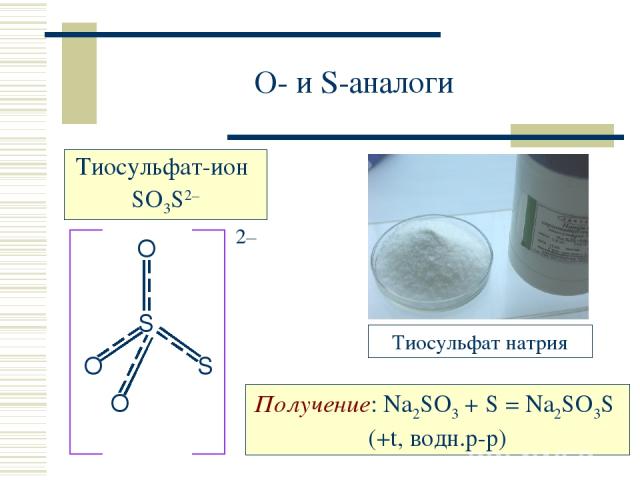
O- и S-аналоги Получение: Na2SO3 + S = Na2SO3S (+t, водн.р-р)
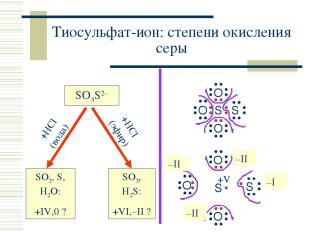
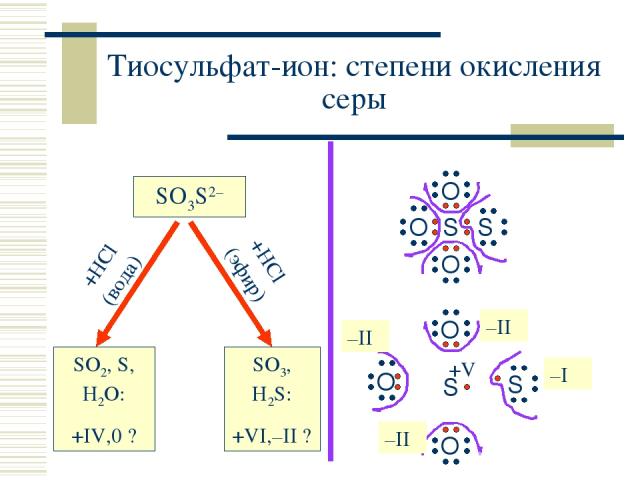
+HCl (вода) +HCl (эфир) Тиосульфат-ион: степени окисления серы SO3S2– SO2, S, H2O: +IV,0 ? SO3, H2S: +VI,–II ? S S O O O –II –II –II –I +V

Химические свойства Na2SO3S + 2HCl = 2NaCl + H2O + SO2 + S SO3S2 + H2O –4e– = 2SO2 + 2H+ SO3S2 + 6H+ +4e– = 2S + 3H2O Na2SO3S + 4Cl2 + 5H2O = Na2SO4 + H2SO4 +8HCl SO3S2 + 5H2O –8e = 2SO42 + 10H+, = +0,275 В Cl2 + 2e– = 2Cl– Na2SO3S + I2 = 2NaI + Na2S4O6 (тетратионат) 2SO3S2 –2e = S4O62 , = +0,015В I2 + 2e– = 2I–

Применение в аналитической химии: иодометрия Cu + 4HNO3 = = Cu(NO3)2 + 2NO2 + H2O 2Cu(NO3)2 + 4KI = = 2CuI + I2 + 4KNO3 KI + I2 = K[I(I)2] K[I(I)2] + 2Na2SO3S = =KI + 2NaI + Na2S4O6
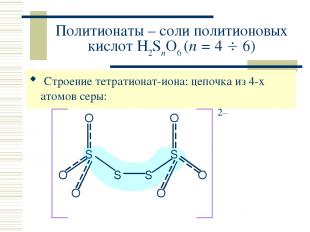
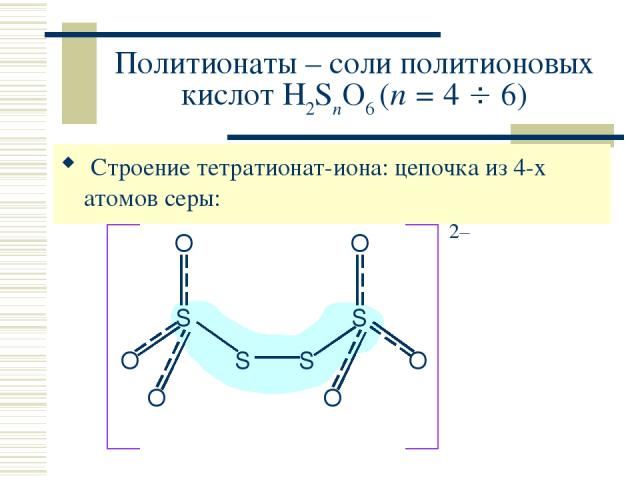
Политионаты – соли политионовых кислот H2SnO6 (n = 4 6) Строение тетратионат-иона: цепочка из 4-х атомов серы:
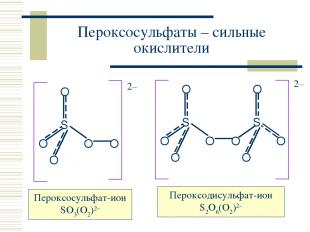
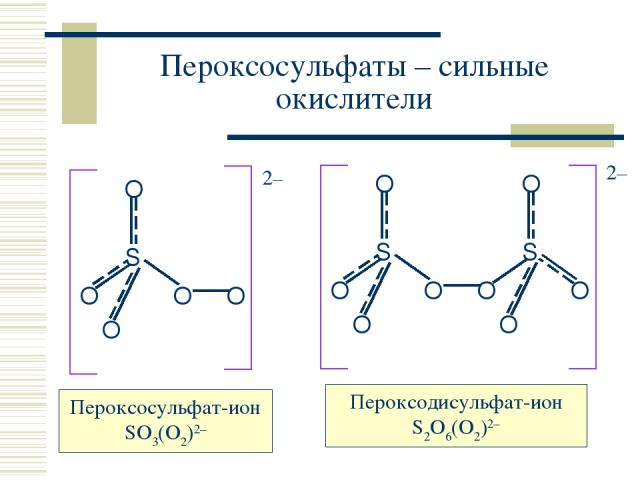
Пероксосульфаты – сильные окислители Пероксосульфат-ион SO3(O2)2– Пероксодисульфат-ион S2O6(O2)2–


![Водный раствор H2S (0,1 моль/л) H2S + H2O HS– + H3O+; KK1 = 1,05 · 10 7 HS– + H2O S2– + H3O+; KK2 = 1,23 · 10 13 [H3O+] = [HS–] = KK1·c0 [S2–] 1,23 · 10 13 моль/л при добавлении HCl (1 моль/л) концентрация [S2–] в сероводородной воде снижается до 1 … Водный раствор H2S (0,1 моль/л) H2S + H2O HS– + H3O+; KK1 = 1,05 · 10 7 HS– + H2O S2– + H3O+; KK2 = 1,23 · 10 13 [H3O+] = [HS–] = KK1·c0 [S2–] 1,23 · 10 13 моль/л при добавлении HCl (1 моль/л) концентрация [S2–] в сероводородной воде снижается до 1 …](https://fs3.ppt4web.ru/images/132073/183932/640/img2.jpg)


![Расчет концентрации сульфид-иона в растворе H2S (0,1 моль/л) 1. H2S + H2O HS– + H3O+ KK1 = 1,05 · 10 7 2. HS– + H2O S2– + H3O+ KK2 = 1,23 · 10 13 K K2= [S2–] [H3O+] [HS–] [...]: С0 x x x [...]: x y y y + x = y (y + x) (x y) = y y = [S2–] K K2 =1,23 … Расчет концентрации сульфид-иона в растворе H2S (0,1 моль/л) 1. H2S + H2O HS– + H3O+ KK1 = 1,05 · 10 7 2. HS– + H2O S2– + H3O+ KK2 = 1,23 · 10 13 K K2= [S2–] [H3O+] [HS–] [...]: С0 x x x [...]: x y y y + x = y (y + x) (x y) = y y = [S2–] K K2 =1,23 …](https://fs3.ppt4web.ru/images/132073/183932/640/img5.jpg)
![Найдем [S2–] в р-ре: H2S (0,1 моль/л) + HCl (1 моль/л) 1. H2S + H2O HS– + H3O+ KK1 = 1,05 · 10 7 2. HS– + H2O S2– + H3O+ KK2 = 1,23 · 10 13 K K2= [S2–] [H3O+] [HS–] [...]: С0 x x x + C1 [...]: x y y y + x + C1 = 3. HCl + H2O = Cl– + H3O+ C1 C1 C1 x … Найдем [S2–] в р-ре: H2S (0,1 моль/л) + HCl (1 моль/л) 1. H2S + H2O HS– + H3O+ KK1 = 1,05 · 10 7 2. HS– + H2O S2– + H3O+ KK2 = 1,23 · 10 13 K K2= [S2–] [H3O+] [HS–] [...]: С0 x x x + C1 [...]: x y y y + x + C1 = 3. HCl + H2O = Cl– + H3O+ C1 C1 C1 x …](https://fs3.ppt4web.ru/images/132073/183932/640/img6.jpg)
![Условия осаждения: С(М2+) С(S2 ) ПР (MS) y = [S2–] 1,29 · 10 21 моль/л В кислотной среде не осаждаются MnS (ПР 10–13), FeS (ПР 10–17) В кислотной среде осаждаются CdS (ПР 10–28), CuS (ПР 10–36), SnS (ПР 10–28), PbS (ПР 10–28) и др. Условия осаждения: С(М2+) С(S2 ) ПР (MS) y = [S2–] 1,29 · 10 21 моль/л В кислотной среде не осаждаются MnS (ПР 10–13), FeS (ПР 10–17) В кислотной среде осаждаются CdS (ПР 10–28), CuS (ПР 10–36), SnS (ПР 10–28), PbS (ПР 10–28) и др.](https://fs3.ppt4web.ru/images/132073/183932/640/img7.jpg)





![Молекула SO3 – неполярная и диамагнитная -модификация SO3 – тример S3O9 -модификация - зигзагоообразные цепочки, состоящие из тетраэдрических фрагментов [SO4] в -модификация цепочки тетраэдров [SO4] объединяются в сетчатые слои. sp2-гибридизация Молекула SO3 – неполярная и диамагнитная -модификация SO3 – тример S3O9 -модификация - зигзагоообразные цепочки, состоящие из тетраэдрических фрагментов [SO4] в -модификация цепочки тетраэдров [SO4] объединяются в сетчатые слои. sp2-гибридизация](https://fs3.ppt4web.ru/images/132073/183932/640/img15.jpg)




![Применение в аналитической химии: иодометрия Cu + 4HNO3 = = Cu(NO3)2 + 2NO2 + H2O 2Cu(NO3)2 + 4KI = = 2CuI + I2 + 4KNO3 KI + I2 = K[I(I)2] K[I(I)2] + 2Na2SO3S = =KI + 2NaI + Na2S4O6 Применение в аналитической химии: иодометрия Cu + 4HNO3 = = Cu(NO3)2 + 2NO2 + H2O 2Cu(NO3)2 + 4KI = = 2CuI + I2 + 4KNO3 KI + I2 = K[I(I)2] K[I(I)2] + 2Na2SO3S = =KI + 2NaI + Na2S4O6](https://fs3.ppt4web.ru/images/132073/183932/640/img24.jpg)