Презентация на тему: Презентация Соединения серы

Соединения серы (VI)

Оксид серы (VI).

Физические свойства серной кислоты. Безводная серная кислота - это бесцветная маслянистая жидкость без запаха, смешивается с водой в любых отношениях, t пл. =10,30 С, t кип = 2960С, =1, 84 г/см3. Обладает сильным водоотнимающим действием.
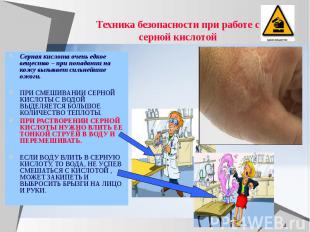
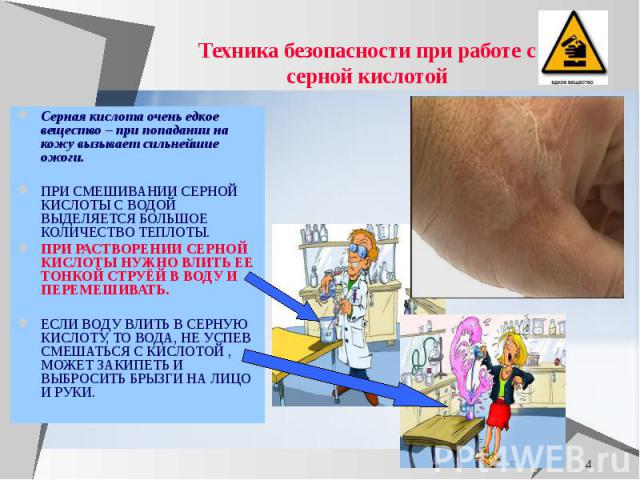
Техника безопасности при работе с серной кислотой Серная кислота очень едкое вещество – при попадании на кожу вызывает сильнейшие ожоги. ПРИ СМЕШИВАНИИ СЕРНОЙ КИСЛОТЫ С ВОДОЙ ВЫДЕЛЯЕТСЯ БОЛЬШОЕ КОЛИЧЕСТВО ТЕПЛОТЫ. ПРИ РАСТВОРЕНИИ СЕРНОЙ КИСЛОТЫ НУЖНО ВЛИТЬ ЕЕ ТОНКОЙ СТРУЁЙ В ВОДУ И ПЕРЕМЕШИВАТЬ. ЕСЛИ ВОДУ ВЛИТЬ В СЕРНУЮ КИСЛОТУ, ТО ВОДА, НЕ УСПЕВ СМЕШАТЬСЯ С КИСЛОТОЙ , МОЖЕТ ЗАКИПЕТЬ И ВЫБРОСИТЬ БРЫЗГИ НА ЛИЦО И РУКИ.

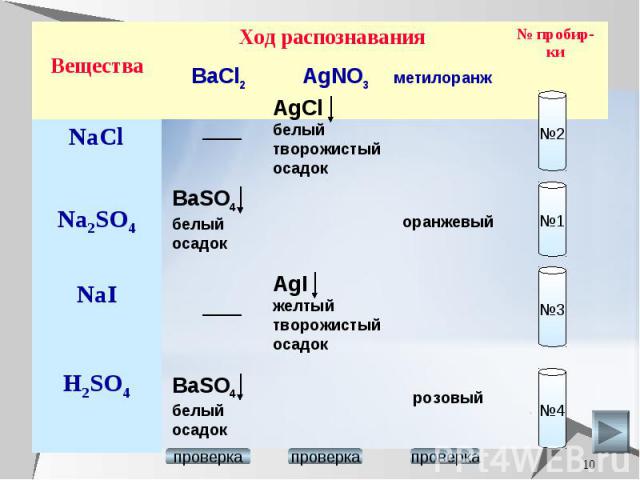
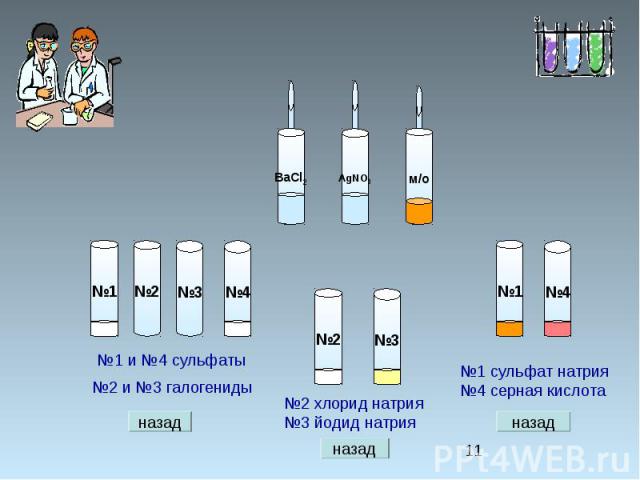
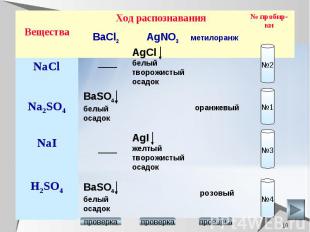
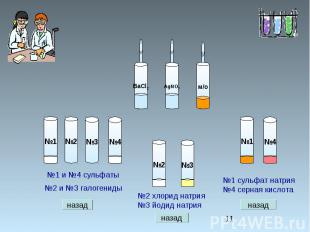
Химические свойства серной кислоты. Выберите, с какими из перечисленных веществ реагирует разбавленная серная кислота: серебро, алюминий, оксид марганца (II), оксид марганца (VII), гидроксид калия, сульфид железа(II), нитрат магния, нитрат бария, карбонат калия. Составьте уравнения возможных реакций в молекулярном и ионном виде.

Раствор серной кислоты взаимодействует с металлами , стоящими в ряду активности до водорода. Ag + H2SO4 = т.к. серебро стоит в ряду активности после водорода 2Al + 3H2SO4 = Al2(SO4)3 +3H2 2Al0 + 6H+ = 2Al 3+ +3H20

Раствор серной кислоты взаимодействует с основными и амфотерными оксидами. МnO + H2SO4 = MnSO4 + H2O МnO + 2H+ = Mn2+ + H2O Mn2O7 + H2SO4 = т.к. Mn2O7 -кислотный оксид

Серная кислота взаимодействует с основаниями и амфотерными гидроксидами. 2КOН + H2SO4 = К2SO4 + 2H2O сульфат калия ОН- + H+ = H2O КOН + H2SO4 = КНSO4 + Н2O гидросульфат калия OН- + 2H+ + SO42- = НSO4- + H2O

Серная кислота взаимодействует с солями, если образуется газ или осадок. FeS + H2SO4 =FeSO4 +H2S FeS + 2H+ =Fe2+ +H2S Mg(NO3)2 + H2SO4 = Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3 Ba2+ + SO42- = BaSO4 K2CO3 + H2SO4 = K2SO4 + CO2 + H2O CO3 2- + 2H+ = CO2 + H2O
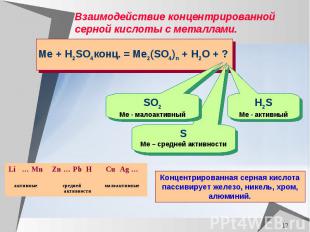
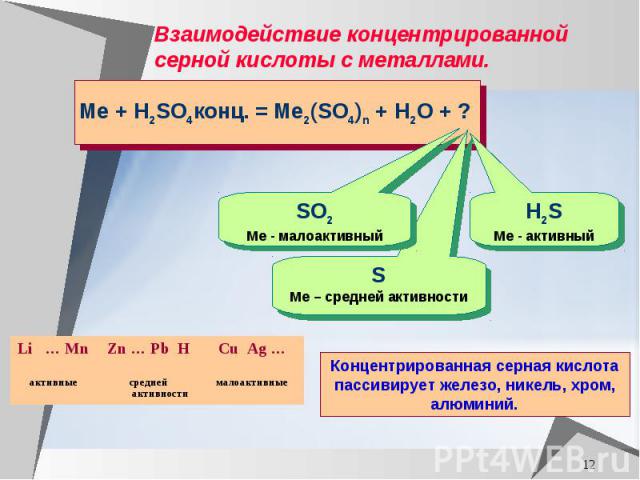
Взаимодействие концентрированной серной кислоты с металлами.

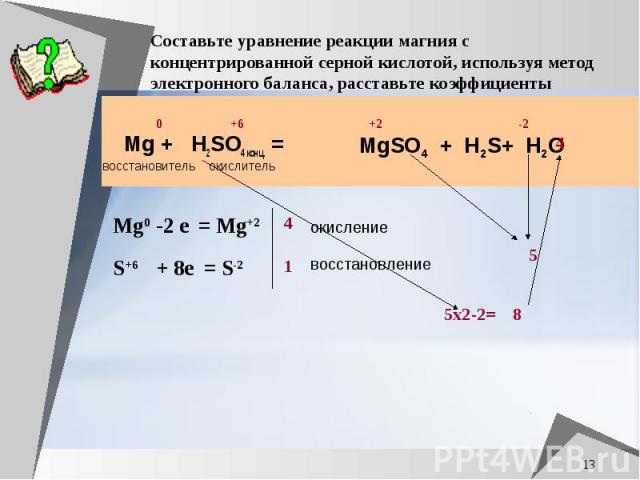
Составьте уравнение реакции магния с концентрированной серной кислотой, используя метод электронного баланса, расставьте коэффициенты Mg + H2SO4 конц. =

Составьте уравнение реакции меди с концентрированной серной кислотой, используя метод электронного баланса, расставьте коэффициенты

Производство серной кислоты Производство H2SO4 в мире неуклонно растет. Так, в период с 2000 по 2005 год оно возросло со 160 до 189 млн тонн. В России объем производства серной кислоты c 2000 по 2005 год возрос в среднем на 1 млн тонн и составил 9,3 млн тонн.

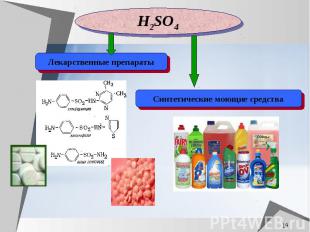
Серная кислота используется для получения фосфорных и азотных удобрений: простого суперфосфата, двойного суперфосфата, преципитата и сернокислого аммония. при производстве 1 т. суперфосфата из фторапатита, не содержащего гигроскопической воды, расходуется 600 кг. 65-процентной серной кислоты

Применение серной кислоты в металлургии «Травление» – обнаружение трещин на поверхности металлов. В гальванических цехах серную кислоту используют для обезжиривания поверхности металла перед нанесением покрытия. Переработка руд редких металлов

Серная кислота используется в качестве электролита в автомобильных аккумуляторах. Серная кислота используется в качестве электролита в автомобильных аккумуляторах.

Вулкан Малый Семячик Вулкан Малый Семячик Вулканический хребет длиной около 3 км., на гребне которого имеются три кратера. В южном (кратер Троицкого) на глубине 170м. находится необычное кислое озеро. Температура этого непрозрачного озера колеблется от +270С до +420С, а уровень минерализации соответствует раствору серной и соляной кислот средней концентрации. Поражают размеры озера: ширина около полукилометра, а глубина - до 140м. Существуют предположения, что кислотное озеро возникло сравнительно недавно в результате извержения вулкана, произошедшего незаметно для людей.

Информационные ресурсы http://www.rcc.ru/Rus/Conferences/ http://www.sigmatec.ru/main/prod/sernaya_kislota CD-ROM Библиотека наглядных электронных пособий. Химия. ООО «Кирилл и Мефодий», 2006