Презентация на тему: Соль 2

Представители солей. Важнейшие соли, используемые человеком в жизни. МОУ лицей №18 Иванова И. Учитель химии Калинина Л.А. 900igr.net

мел тонкозернистый, мягкий, белый известняк, состоящий из мелких обломков и целых известковых скелетов микроорганизмов (кокколитов, фораминифер и др.). Применяют в цементной, стекольной, резиновой и др. отраслях промышленности.

мрамор от греч. marmaros — блестящий камень, горная порода, образовавшаяся в результате перекристаллизации и метаморфизма известняков и доломитов. Разнообразен по окраске, нередко с красивым узором, хорошо принимает полировку. Декоративный и поделочный камень.

известняк осадочная горная порода, состоящая главным образом из кальцита, редко — из арагонита; часто с примесью доломита, глинистых и песчаных частиц. Известняки нередко содержат остатки известковых скелетов ископаемых организмов. Используется в металлургии (флюсы ), строительстве, химической промышленности и др.

кораллы КАЛЬЦИТ (известковый шпат), минерал класса карбонатов, СаСО3. Примеси Mg, Fe, Mn и др. Твердость 3; плотность 2,7 г/см3. Разновидности: исландский шпат, бумажный шпат (листоватый), антраконит — черный кальцит. Строительный и поделочный материал; металлургический флюс.

Гипс от греч. gypsos — мел, известь, минерал класса сульфатов, CaSO4·2H2O. Бесцветные, белые, серые кристаллы, Твердость 1,5-2; плотность 2,3 г/см3. Разновидности: гипсовый шпат (полупрозрачные кристаллы); атласный шпат, или уральский селенит (параллельно-волокнистые агрегаты с шелковистым блеском), и алебастр (снежно-белый тонкозернистый гипс). Используется в строительстве, для гипсования почв, в медицине.

Поваренная соль НАТРИЯ ХЛОРИД (поваренная соль), NaCl, бесцветные кристаллы. Растворяется в воде. В природе натрия хлорид широко распространен в виде каменной соли (галита), содержится в морской воде. Важная пищевая приправа; идет на получение едкого натра, хлора, соды.
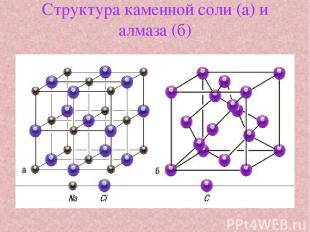
Структура каменной соли (а) и алмаза (б)

СОДА Техническое название карбонатов натрия. Нормальный карбонат Na2CO3 называется содой кальцинированной; гидрокарбонат NaHCO3 — питьевой (пищевой). Бесцветные кристаллы, раствори- мость соответственно 14,9 г и 9,6 г в 100 г воды при 20 °С; водные растворы имеют щелочную реакцию. Na2CO3 получают главным образом насыщением NH3 и СО2 раствора NaCl и дальнейшим нагрева- нием до 1400 -160 °С, Na2CO3 применяют в стекольной, мыловаренной, текстильной, целлюлозно-бумажной промышленности, для очистки нефти и т. д. NaHCO3 — в производстве искусственных минеральных вод, в медицине, быту.

МЕДИ СУЛЬФАТ CuSO4 - сернокислая медь. Растворяется в воде. Из водных растворов кристаллизуется CuSO4 5H2O — медный купорос (ярко-синего цвета), который применяется в сельском хозяйстве (для борьбы с вредителями и для протравливания зерна) и при получении минеральных красок.

АММОНИЯ ХЛОРИД NH4Cl- нашатырь, бесцветные кристаллы. Азотное удобрение (до 25% N) для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора (сахарная свекла, рис, кукуруза). Применяют также в производстве сухих гальва- нических элементов, при паянии и лужении, в медицине, как дымообразователь.

КАЛИЯ ПЕРМАНГАНАТ KMnO4, темно-фиолетовые кристаллы. Растворим в воде. Цвет раствора красно-фиолетовый. Сильный окислитель. Применяют для отбеливания тканей, в фотографии, аналитической химии, как антисептическое средство в медицине. Марганцевые руды:

ХЛОРАТЫ соли хлорноватой кислоты HClO3. Кристаллы; при обычной температуре устойчивы, при нагревании взрывоопасны. Важны: калия хлорат (бертоллетова соль), хлорат натрия NaClO3 и хлорат магния Mg(ClO3)2. Хлораты применяют как окислители, гербициды и дефолианты. Ядовиты.

БУРА Na2B4O7.10H2O. В природе — минерал класса боратов, химический осадок усыхающих бороносных соляных озер (напр., оз. Серлс, США). Бесцветные кристаллы, tпл 60,8 °С, плохо растворяется в воде. Компонент флюсов для сварки металлов, шихты для глазурей, стекла и керамики, моющих средств, антисептик, консервирующее средство.

НИТРАТЫ соли азотной кислоты HNO3, твердые хорошо растворимые в воде вещества. Традиционное русское название некоторых нитратов щелочных и щелочноземельных металлов и аммония — селитры (аммонийная селитра NH4NO3, калийная селитра КNO3, кальциевая селитра Са(NO3)2 и др.

Нахождение в природе и получение Нитрат натрия NаNO3 (чилийская селитра) и нитрат калия КNO3 (индийская селитра) встречаются в природе в Индии и в Чили. В России натриевую селитру в виде белого налета получали при гниении различных органических остатков растительного и животного происхождения. Так как нитрат натрия гигроскопичен и не годится для изготовления пороха, его превращали в нитрат калия обработкой горячим насыщенным раствором КСl. В настоящее время нитраты натрия и калия получают при нейтрализации азотной кислоты с использованием соды Na2CO3, поташа K2CO3 и др.

Физиологическое действие Нитраты токсичны. Неорганические нитраты вызывают отек легких, тошноту, рвоту, острую сердечно-сосудистую недостаточность. Смертельная доза для человека 8-15 мг/л, допустимое суточное потребление 5мг/л. Для суммы нитратов Na, K, Ca, NH4 Пдк: в воде 45 мг/л, в почве 130 мг/кг, в овощах и фруктах (мг/кг): картофель 250, капуста белокочанная поздняя 500, морковь поздняя 250, свекла 1400, лук репчатый 80, кабачки 400, дыни 90, арбуз, груши, яблоки 60. Вдыхание паров органических нитратов, попадание их на кожу и в пищеварительный тракт вызывает головную боль, учащенное сердцебиение. Окисляют гемоглобин в метгемоглобин.

Применение Нитраты аммония, натрия и калия широко применяют как минеральные азотные удобрения. Так как нитраты хорошо растворимы в воде, то после внесения этих удобрений в почву они быстро оказываются в растениях. Поэтому существует опасность избыточного содержания нитрат-ионов в плодах.