Презентация на тему: Соли аммония

ПРЕЗЕНТАЦИЯ ПО ХИМИИ СОЛИ АМОНИЯ 900igr.net

КАТИОН АМОНИЯ Катион аммония NH4 играет роль катиона метала и образует с кислотными остатками соли: NH4NO3 – нитрат аммония, или аммиачная селитра. (NH4)2 SO4 – сульфат аммония.

СОЛИ АММОНИЯ СОЛИ АММОНИЯ – ТВЁРДЫЕ КРИСТАЛИЧЕСКИЕ ВЕЩЕСТВА, ХОРОШО РАСТВОРИМЫЕ В ВОДЕ. по ряду свойств они похожи на соли щелочных металлов, и в первую очередь на соли калия, так как радиусы ионов калия и NH4 приблизительно равны. Соли аммония получают взаимодействием аммиака или его водного раствора с кислотами.

Соли аммония обладают всеми свойствами солей, обусловленными наличием кислотных остатков. Карбонат аммония взаимодействует с кислотами, так как в результате реакции образуется углекислый газ. Ион аммония обусловливает другое, общее для всех солей аммония, свойство: его соли реагируют с щелочами при нагревании с выделением аммиака, например: NH4Cl+NaOH=NH3+H2O+NaCl

Третья группа свойств солей аммония – это их способность разлагаться при нагревании с выделением газообразного аммиака, например: NH4Cl=NH3+HCl В этой реакции образуется также хлороводород, который улетучивается вместе с аммиаком , а при охлаждении снова соединяется с ним, образуя соль.
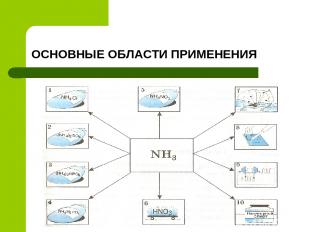
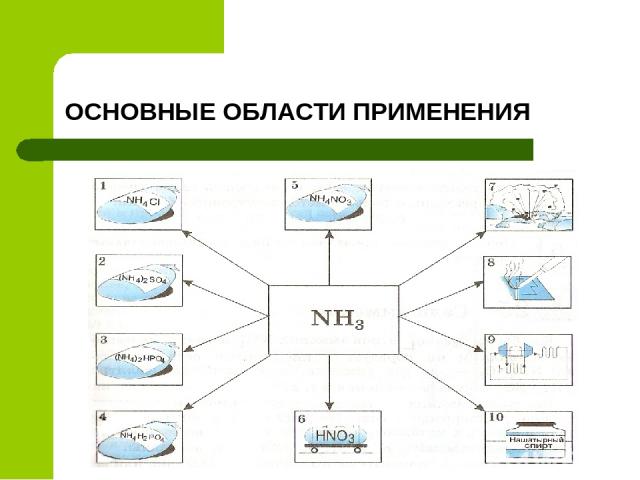
ОСНОВНЫЕ ОБЛАСТИ ПРИМЕНЕНИЯ

Опыт. Возгонка хлорида аммония.