Презентация на тему: Основные виды химической связи

Строение вещества Основные виды химической связи 900igr.net

Электроотрицательность Свойства атомов одного элемента оттягивать электроны от других элементов. Табл. 19 стр 140 Литий ЭО = 1 Фтор ЭО = 4 Табл стр. 140

Значение ЭО Если ЭО меньше 2 то это металл Если ЭО больше 2 то это неметалл В периоде ЭО возрастает В группе ЭО уменьшается Чем больше металличность, тем меньше ЭО Чем больше неметалличность, тем больше ЭО

Сравнить ЭО Na и K Ba и Ca O и S F и Cl

По ЭО определить Ме или Неме табл.19 стр 140 Хром Хлор Цинк Стронций Кремний

Что такое электроотрицательность? Пользуясь п.с. распределите перечисленные элементы в порядке возрастания значений электроотрицательности фосфор, магний, бор, цезий, кислород, кремний, калий, углерод, водород, литий , фтор, сера, алюминий ,кальций.

Ответ: Cs K Li Ca Mg Al B H Si P C S O F

Тест В ряду элементов F→ Cl→ Br→ I с увеличением порядкового номера химического элемента ЭО Увеличивается Уменьшается Не изменяется Изменяется периодически Ответ: 2

Задание В приведенных ниже формулах подчеркните атомы наиболее ЭО элементов KCl ; Na2O; N2 ; HI ; H2S ; AlBr3

Химическая связь Химическая связь – это сила которая удерживает атомы в молекуле Главную роль играют электроны Электроны образуют электронный октет (8 е)
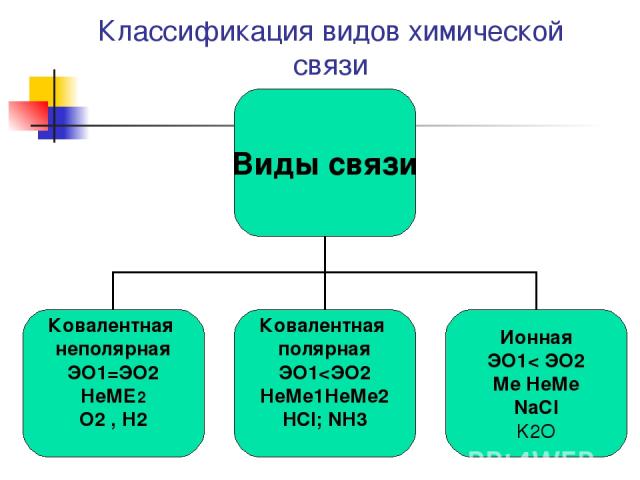
Классификация видов химической связи

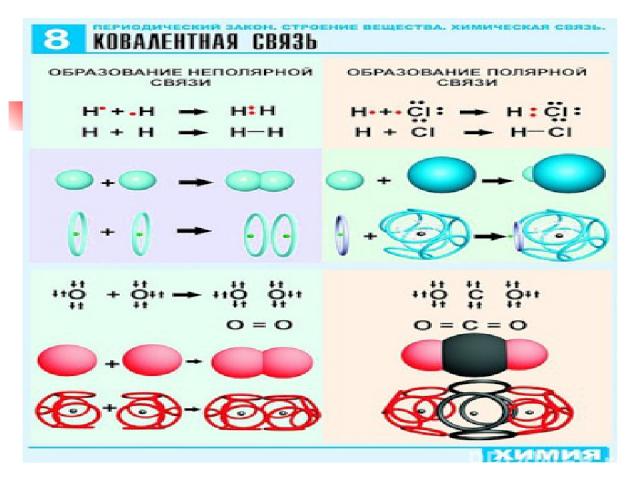
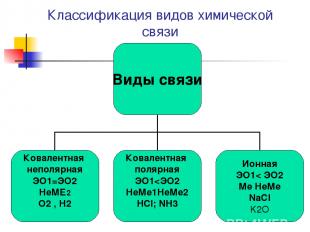
Виды химической связи Теория ковалентной связи предложил в 1916 г Джильбер Льюис Ковалентная связь- Это связь атомов с помощью общих электронных пар Ковалентная неполярная Н2 ,О2; F2 ;Cl2 Ковалентная полярная HCl; NH3; H2O
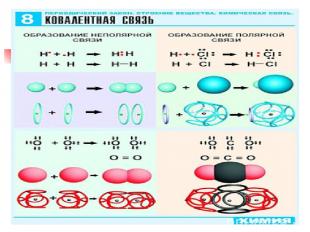
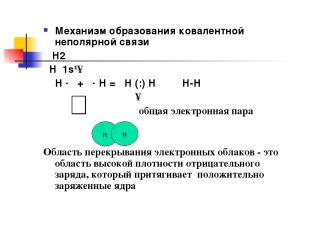
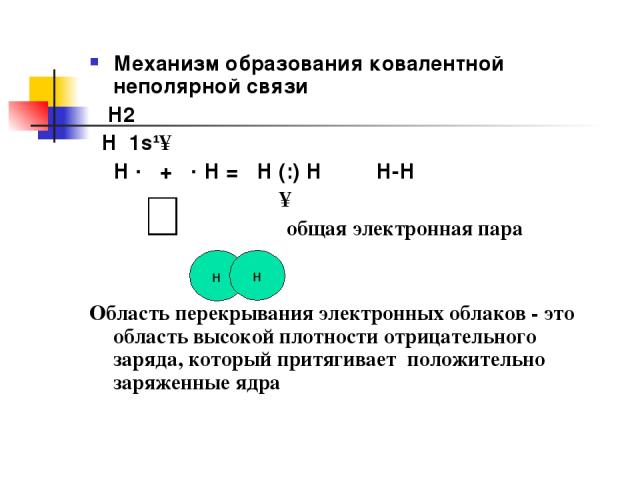
Механизм образования ковалентной неполярной связи Н2 Н 1s¹↑ Н · + · Н = Н (:) Н Н-Н ↑ общая электронная пара Область перекрывания электронных облаков - это область высокой плотности отрицательного заряда, который притягивает положительно заряженные ядра н н


Ковалентная неполярная связь образуется между атомами с одинаковой ЭО ( Н2, О2) Ковалентная полярная связь образуется между атома ЭО у которых отличается незначительно( НCl; H2O)

О2 О 1s²2s²2p4 .. .. .. .. : O · + · О : → : О :: О : О=О · · двойная связь


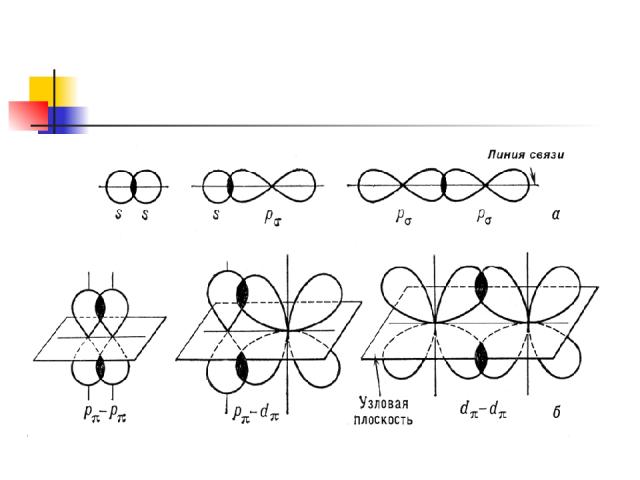
Ơ- связь это ковалентная связь, при образовании которой область перекрывания электронных облаков находится на линии, соединяющей ядра атомов ------------- - ------------

ɲ - это связь , при образовании которой область перекрывания электронных облаков находится по обе стороны по линии соединяющий ядра атомов
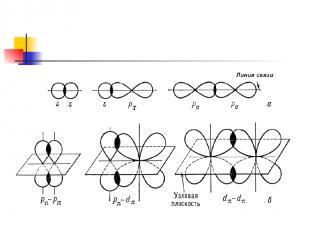

Одинарная связь – ơ Двойная связь - 1 ơ , 1 ɲ Тройная связь 1 ơ , 2 ɲ -с-с- одинарная -с = с- двойная -с Ξ с- тройная

Механизм образования ковалентной полярной связи ·· δ+ δ- ·· Н· + · Cl : → Н | (:) Cl : ·· ·· δ+ частичный положитедьный заряд δ- частичный отрицательный заряд ЭО н= 2,1 ЭОсL = 3,0
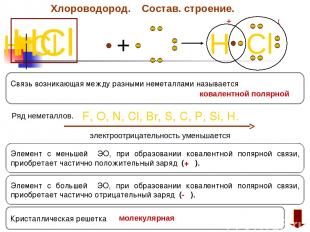
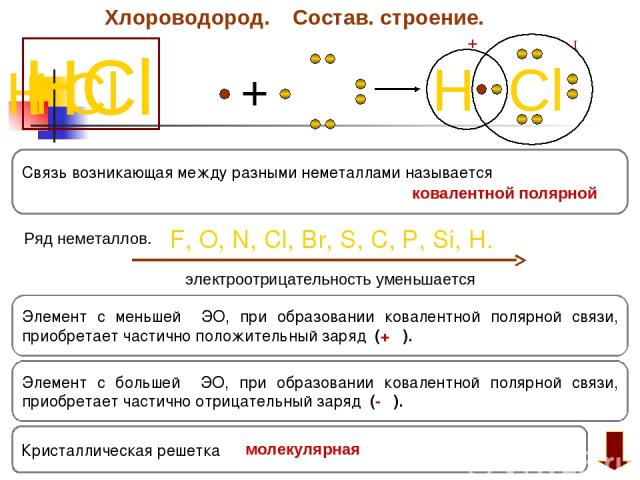
Хлороводород. Состав. строение. HCl H Cl + H Cl +δ ─ δ Элемент с большей ЭО, при образовании ковалентной полярной связи, приобретает частично отрицательный заряд (- δ). Элемент с меньшей ЭО, при образовании ковалентной полярной связи, приобретает частично положительный заряд (+ δ). F, O, N, Cl, Br, S, C, P, Si, H. электроотрицательность уменьшается Связь возникающая между разными неметаллами называется Ряд неметаллов. Кристаллическая решетка ковалентной полярной молекулярная

Полярность связи тем больше, чем разность ЭО связанных атомов. Полярные молекулы являются диполями. + -

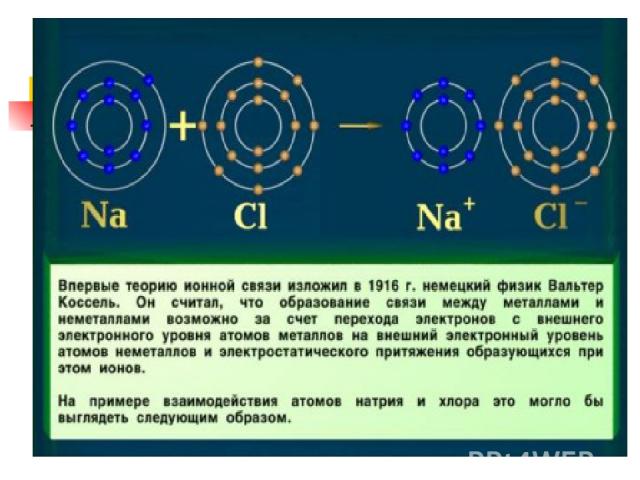
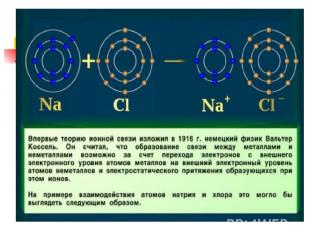
Ионная связь Теория ионной связи предложил в 1916 г. немецким ученый В. Коссель. Ионная связь это связь между ионами Ме НеМе NaCl ; CaCl2 ; K2O ; Al2S3
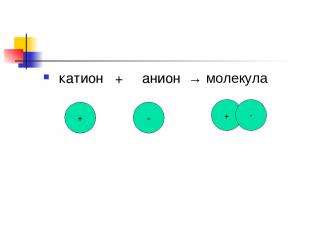
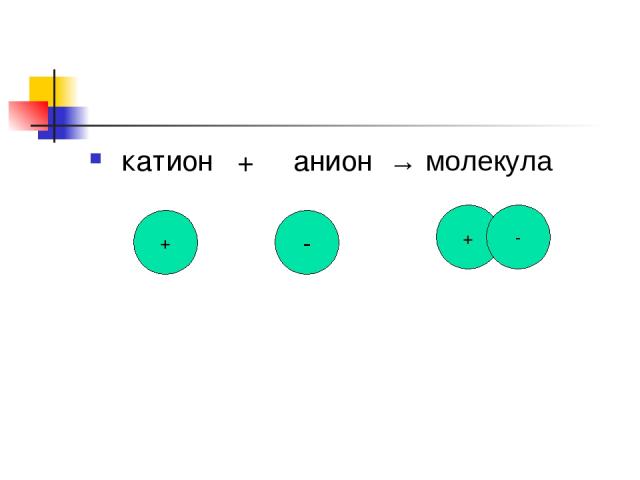
катион + анион → молекула + - + -

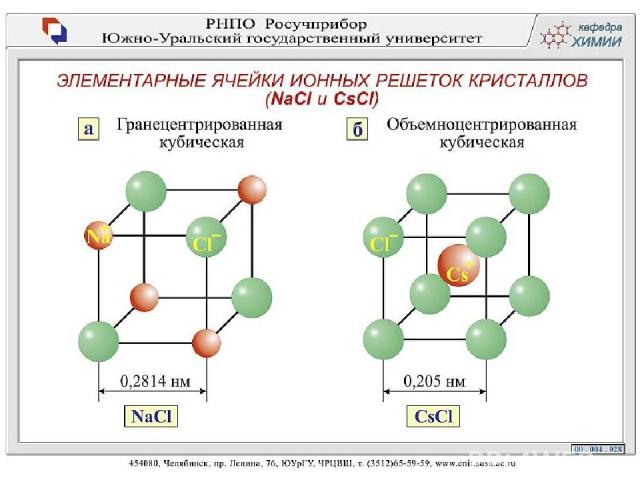
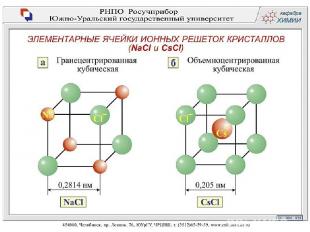
Соли соляной кислоты (хлориды) Хлорид натрия 1. Состав NaCl 2. Строение Химическая связь между катионами и анионами, обусловленная их взаимным притяжением, называется ионной Схема образования ионной связи в хлориде натрия: Na + Cl Na Cl + − или Na 23 11 0 ) ) ) 2 8 1 + Cl 35 17 ) ) ) 7 8 2 0 Na ) ) 11 23 Cl + ) ) ) 8 8 2 8 2 − 35 17 ион натрия ион хлора Na0 − 1e → Na+ Cl 0 + 1e → Cl −

Механизм образования ионной связи 0 0 Na + Cl → Na+ Cl¯ Na – 1 e → Na + Cl + 1e → Cl ¯ 1.Образование ионов 2.Соединение ионов

Как определить тип связи? Тип связи определяется по разности ЭО ∆ЭО =0 ковалентная неполярная связь Н-Н ∆ЭО < 1,7 ковалентная полярная Н-Cl ЭОн =2,1 ЭОcL= 3,0 ∆ЭО ≥ 1,7 ионная связь NaCl ЭОNa=1,01 ЭОсL = 3,0

Энергия связи Энергия, которую надо затратить на разрыв связи ( мера ее прочности) Измеряется в кдж/моль Зависит от 1.Природы взаимодействующих атомов 2.Их размеров 3. ЭО 4. Прочность ơсвязи больше ɲсвязи.
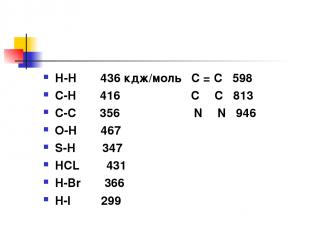
Н-Н 436 кдж/моль C = C 598 С-Н 416 C Ξ C 813 С-С 356 N Ξ N 946 О-Н 467 S-H 347 HCL 431 H-Br 366 H-I 299

Пространственное строение молекул неорганических и органических веществ. Направление ковалентной связи 1)Линейные 2)Угловые 3)Тетраэдрические Причина: различие расположения электронных орбиталей в пространстве.

Гибридизация. Гибридизация- выравнивание электронной плотности (меняется форма электронных облаков) sp³ - алканы,циклоалканы, NH3; H2O Тетраэдр, валентный угол 109° 28´, 107,3°,104,5° рис. №11 стр 32. sp² - алкены, алкадиены, арены; ВСl3 Угловая ,валентный угол 120° sp - алкины; BeF2 Линейная молекула, валентный угол 180°

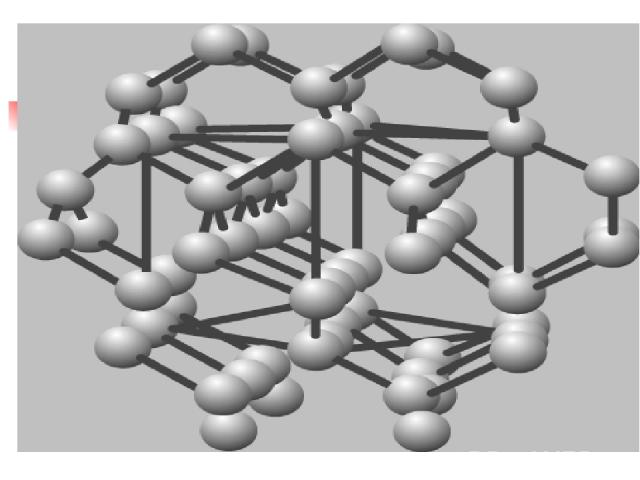
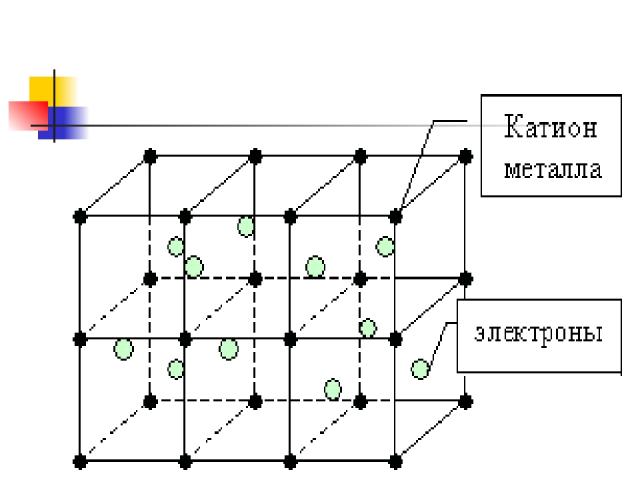
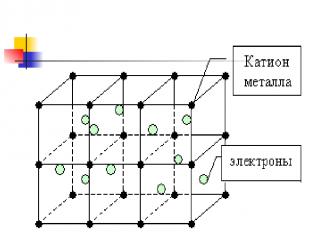
Металлическая связь Возникает в кристаллической решетке металлов между свободными электронами и узлами кристаллической решетки( атомы и ионы)

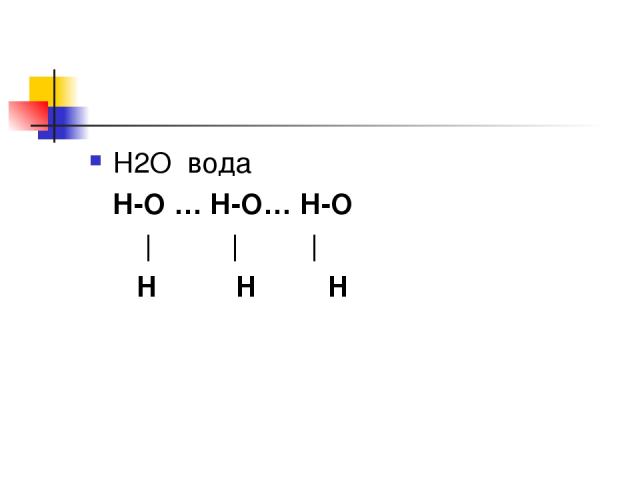
Водородная связь Связь между атомами водорода одной молекулы и атомами ЭО элементов (О; N ; Cl; F; S) 1. внутримолекулярная 2. межмолекулярная
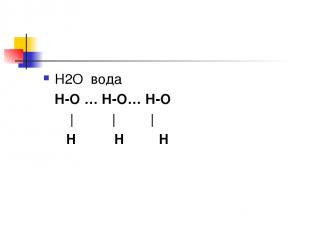
Н2О вода Н-О … Н-О… Н-О | | | H H H
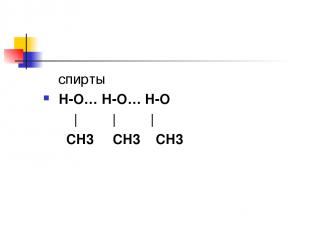
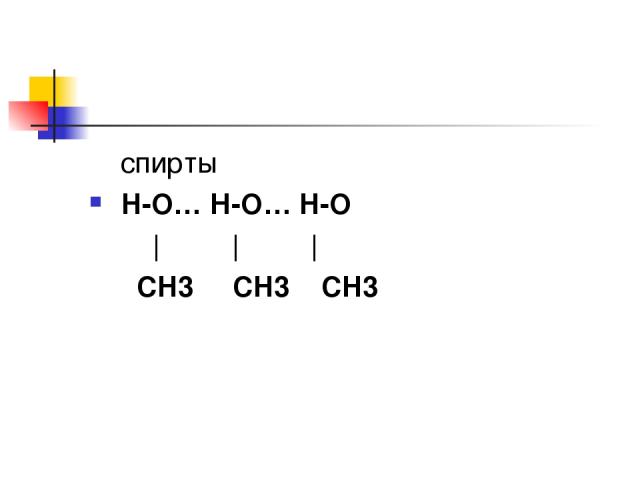
спирты H-O… Н-O… H-O | | | СH3 СH3 СH3

Вопросы и упражнения Что такое химическая связь? Какие основные виды химической связи вы знаете? В каких молекулах присутствует ковалентная неполяная связь? В каких молекулах присутствует ковалентная полярная связь? В каких молекулах присутствует ионная связь? Что такое сигма связь? Что такое пи связь?

Вопросы и упражнения Определить тип химической связи H2S ; NH3; H2 ; K2O; Al2S3; N2; P2O5; Na2SO4; SO3; CH4; KBr; Какая связь образуется между элементами с №1 и №9; №11 и№16 Какая молекула более полярна НF – HCl - HBr – H I

Вопросы о упражнени. Составить схемы образования связей а) хлорид лития б) молекула фтора в) молекула воды г) молекула фтороводорода

В каких молекулах длина связи больше? 1) H2O 2) H2S 3) H2Se Какая молекула прочнее?

Тест Ионная связь образуется Между элементами с одинаковым ЭО Между элементами ,у которых ЭО отличается незначительно Между элемента, у которых ЭО отличатся значительно.

Тест Ионная связь характерна для CH4 NaF N2 SiO2 Ответ: 2

Тест Между атомами элементов с порядковыми номерами 9 и 19 образуется химическая связь Ковалентная полярная Ковалентная неполярная Ионная Металлическая Ответ: 3

Напишите структурную формулу 4,5 диметил гексен -1 3метил4 этил гетин-1 1. Определите количество сигма и Пи связей 2.Определить типы гибридизации каждого атома углерода

Упражнения Зарисовать механизм образования в молекулах В молекуле кислорода В молекуле хлороводорода В хлориде кальция
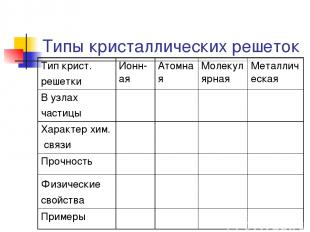
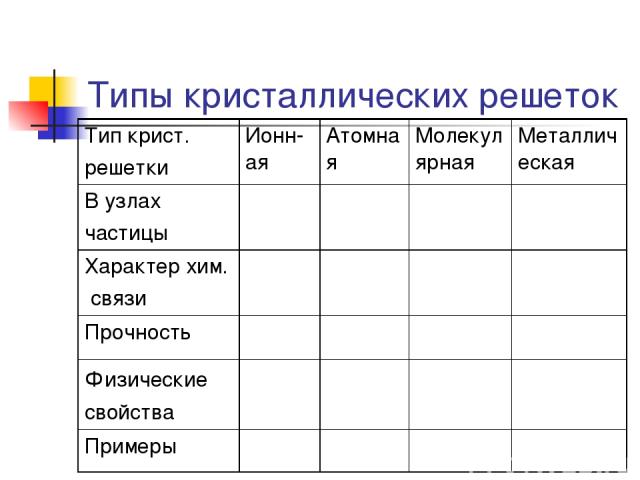
Типы кристаллических решеток Тип крист. решетки Ионн-ая Атомная Молекулярная Металлическая В узлах частицы Характер хим. связи Прочность Физические свойства Примеры

Типы кристаллических решеток Рис. 12 стр 32 Ионная кристаллическая решетка В узлах находятся + ионы и – ионы Ионная связь. Прочная. Свойства: тугоплавкие, твердые, многие растворимы в воде. Растворы т расплавы проводят эл. ток. Пример: соли, щелочи, основные оксиды.
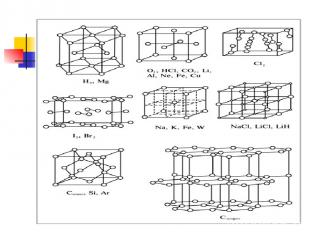

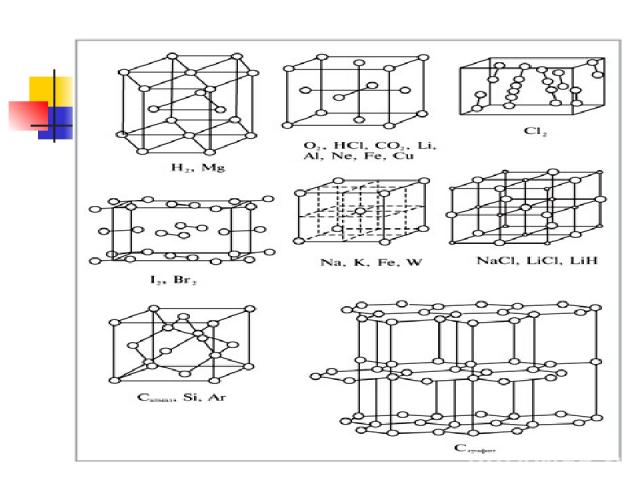
Типы кристаллических решеток Самостоятельно Зарисовать типы кристаллических решеток Атомной – алмаз Ионной – поваренная соль Молекулярная – иод Металлическая Стр 32 рис.12

Атомная кристаллическая решетка В узлах находятся атомы. Связь ковалентная. Очень прочная. Свойства: очень тугоплавкие, очень твердые, практически нерастворимы в воде. Плохо проводят ток и тепло. Примеры: Алмаз, графит, кремний бор, оксид кремния SiO2
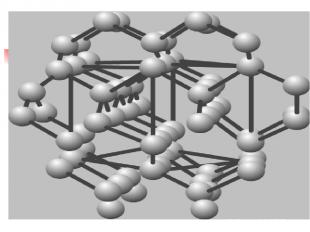

Молекулярная решетка В узлах находится молекулы. Прочность слабая. Связь –силы межмолекулярного взаимодействия и водородные связи. Прочность слабая. Свойства: легкоплавкие, низкие температуры плавления и кипения небольшая твердость Примеры: иод I2; лед , cухой лед (СО2) О2 , Н2 , СL2, ,белый фосфор Р4, сахар, глицерин, глюкоза, глицерин, нафталин, сера S8


Металлическая кристаллическая решетка В узлах атомы и положительно заряженные ионы. Металлическая связь . Разной прочности Свойства: разнообразны по свойствам имеют металлический блеск, электро и теплопроводны, большинство пластичны. Примеры: металлы

Причины многообразия веществ Изотопия элементов и их соединений. Н- образует 3 изотопа Протий Н ¹1 Дейтерий Н ²1 Тритий Н³1

Аллотропия-явление существования элементов в виде нескольких простых веществ С – графит,алмаз, карбин,фуллерен. Р – белый, красный,черный. О – кислород О2, озон О3 Изомерия Структурная -цепи -кратной связи -функциональной группы - межклассовая Пространственная

Гомология Гомологи- это вещества которые отличаются на одну или несколько групп СН2( гомологическая разность) Химический синтез новых веществ Неорганических вешеств 500 000 тыс Органических веществ 12 млн.

Вопросы и упражнения Определите тип кристаллической решетки: Хлорид кальция,алюминий, иод, графит. Самыми твердыми веществами являются Диоксид кремния Алмаз Красный фосфор

Кристаллическая решетка твердой серы? Молекулярную кристаллическую решетку имеет А)Калий Б)Литий В)Магний Г)Водород

Кислород и озон имеют кристаллическую решетку… а)ионная 1)диссоциируют б) атомная 2)низкая реакци- в) молекулярная онная способ- г) металлическая ность 3)низкая Т плав. 4)металлич. блеск

Дисперсные системы Грубодисперсные- мутные частицы видны невооруженным глазом.(Геторогенные) Легко разделяются. Размер частиц 100нм 1)суспензия а)глина и вода б)мел и вода 2) Эмульсии а) смесь растительного масла и воды

Тонкодисперсные системы (гомо- генные) –прозрачные. Частицы обнаруживаются только при помощи ультрамикроскопа. Осаждаются с трудом. 1)Коллоидные растворы (1-100нм) Золи - твердые вещества + жидкость (желатин+ вода) Гели - жидкость + жидкость (яичный белок+вода) Аэрозоли - Газ + жидкость ( туман , дым

Истинные растворы(гомогенные) прозрачные размер частиц меньше 1нм. Частицы невидны даже под микроскопом. Не осаждаются. 1) раствор сахара в воде 2) раствор серной кислоты

Повторить Раствор -? Классификация растворов- ? Водные растворы -? Неводные растворы -? Гидротация -? Гидротированный ион -? Кристаллогидрат -? Насыщенный раствор -? Ненасыщенный раствор-? Концентрированный -? Разбавленный -?

Способы выражения концентрации растворов. Массовая доля растворенного вещества mр.в. ωр.в.= ――― · 100% m р-ра mр-ра = m растворителя + m р.в. Н2О

Упражнения и задачи В растворе массой 100г содержится хлорид бария массой 20г. Какова массовая доля хлорида бария в растворе? Сахар массой 5г растворили в воде массой 20г Какова массовая доля сахара в растворе? Какова масса нитрата калия и воды ,которые необходимо взять для приготовления 2 кг раствора с массовой долей нитрата калия равной 0,05? При выпаривании 500г 10% раствора сульфата лития получили раствора массой 200г. Какова концентрация полученного раствора?

Задачи К 250г 10% раствора прилили 150млводы (ƥ= 1г/мл) Какова массовая доля глюкозы в полученном после разбавления растворе? В 200г воды растворили 67,2л сероводорода (н.у.) Определите массовую долю сероводорода в растворе. Какие массы кристаллогидрата сульфата натрия Na2SO4 · 10H2O и воды надо взять, чтобы получить раствор массой 71г с массовой долей Na2SO4 20%?

Молярная концентрация Молярная концентрация показывает число молей растворенного вещества в одном литре раствора. ע С= ―― моль/л V ע- количество вещества (ню) V- объем раствора

Молярная концентрация. 1М – одномолярный (1моль на 1л) 0,1М децимолярный ( 0,1моль на 1л) 0,01М сантимолярный (? ) 0,001М миллимолярный (? ) Плотность раствора m ƥ = ―― ƥ H2O = 1г/мл или 1г/см³ V

Решение задач Раствор объемом 500мл содержит гидроксид натрия массой 5г. Определить молярную концентрацию этого раствора. Вычислить массу хлорида натрия , содержащего в растворе объемом 200мл, если его молярная концентрация 2 моль/л Вычислить молярную концентрацию раствора серной кислоты , если массовая доля серной кислоты в этом растворе 12%. Плотность раствора 1,08 г/мл.

Решение задач. Молярная концентрация раствора едкого кали КОН 3,8 моль/л, его плотность 1,17 г/мл. Вычислить массовую долю КОН в этом растворе. К 500 мл 20% раствора серной кислоты. Плотность раствора 1,2г/мл. Прилили 250 мл воды. Определить молярную концентрация серной кислоты в новом растворе?

Практическая работа №1 Тема№1 Приготовление растворов с заданной концентрацией. Цель: научиться готовить растворы с заданной молярной и процентной концентрацией. Оборудование: мерная посуда, весы. Вещества: хлорид натрия, карбонат натрия.

Ход работы 1. Правила техники безопасности. 2. Приготовит растворы. 3. Решить задачи. 4. Вывод.

Решить задачи 1.Необходимо приготовить раствор массой 50г с массовой долей 12% поваренной соли. Вычислите массу соли и воды, которые необходимо взять для приготовления раствора 2.Вычислить массовую долю раствора растворенного вещества первого и второго раствора , если было взято 60 г воды и 12 г соды, а затем добавили 30г воды и 8 г соды

Решить задачи 3. Рассчитайте массу соли и воды, которую необходимо взять для приготовления 100мл 0,1 М раствора хлорида натрия плотностью 1,1 г/мл 4. Рассчитайте массу соли и воды, которую необходимо взять для приготовления 100мл 0,2М раствора карбоната натрия плотность 1, 2 г/мл

Решить задачи. 3.Вычислить массовую долю растворенного вещества если для приготовления раствора было взято 100г воды и 20 хлорида натрия , а затем добавили еще 100г воды и10г соли. Раствор выпарили масса раствора оказалась 150 г. 4. Вычислить объем газа , который выделится при взаимодействии 100мл раствора карбоната натрия плотностью 1,25г/мл и массовой долей растворенного вещества 12% с раствором соляной кислоты.