Презентация на тему: Основания, соли, кислоты, оксиды

Химические свойства опорные конспекты Оксиды, основания, кислоты и соли 900igr.net

КИСЛОТЫ 1 Действие кислот на индикаторы HCl → H+ + Cl- метилоранж красный H2SO4→ H+ + HSO4- ; HSO4- ↔ H+ + SO42- универсальный красный 2 Реакция нейтрализации Н+ + ОН- = Н2О, ∆Н < 0 (можно увидеть только с индикатором) 2Fe(OH)3(н) + 6H+(сильная кислота) = 2Fe3+ + 3H2O, ∆Н < 0 3 Соль (р, м, н) + кислота → соль + кислота (↓ или ↑) 2H+ + SiO32-→H2SiO3↓; СаСО3 + 2Н+→Са2+ + Н2О + СО2↑ *С солями (н, м) реагируют только сильные кислоты 4 Кислота + основный оксид = соль + H2O 3Н2SО4 + Fe2O3 = Fe2(SO4)3 + 3Н2О 6H+ + Fe2O3 = 2Fe3+ + 3H2O 5 Кислота + металл (в ряду активности до Н2) = соль + Н2↑, ∆Н < 0 Zn + 2H+(кроме HNO3) = Zn2+ + Н2↑, ∆Н < 0
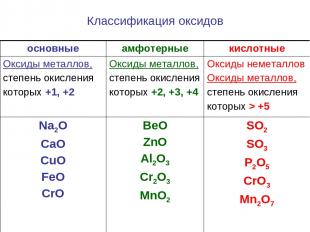
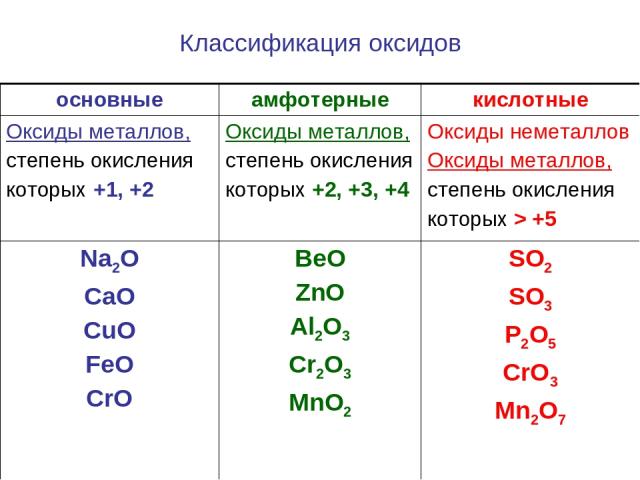
Классификация оксидов основные амфотерные кислотные Оксиды металлов, степень окисления которых +1, +2 Оксиды металлов, степень окисления которых +2, +3, +4 Оксиды неметаллов Оксиды металлов, степень окисления которых > +5 Na2O CaO CuO FeO CrO BeO ZnO Al2O3 Cr2O3 MnO2 SO2 SO3 P2O5 CrO3 Mn2O7

1. Кислотные свойства проявляет оксид: 1) SiO2 2) Al2O3 3) CO 4) BaO 3. Установите соответствие между формулой вещества и классом соединений, к которому это вещество принадлежит: А) оксид азота (II) 1) кислотный оксид Б) оксид кальция 2) основный оксид В) оксид серы (IV) 3) несолеобразующий оксид Г) оксид углерода (II) 4) амфотерный оксид 2. Оксид с наиболее выраженными основными свойствами образует: 1) Be 2) Mg 3) Ba 4) Zn

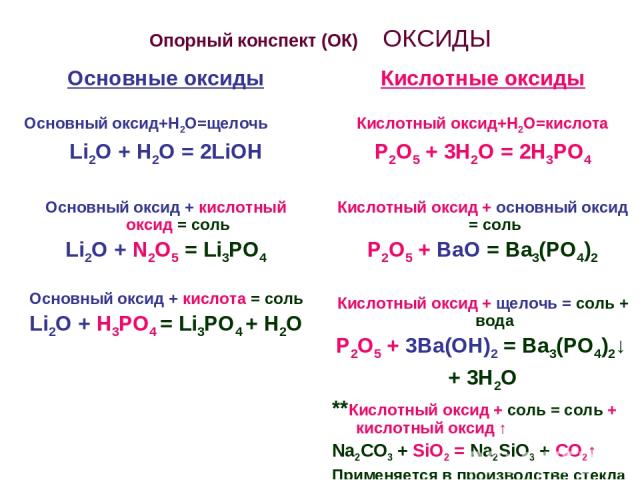
Опорный конспект (ОК) ОКСИДЫ Основные оксиды Основный оксид+Н2О=щелочь Li2O + H2O = 2LiOH Основный оксид + кислотный оксид = соль Li2O + N2O5 = Li3PO4 Основный оксид + кислота = соль Li2O + Н3РО4 = Li3PO4 + Н2О Кислотные оксиды Кислотный оксид+Н2О=кислота Р2О5 + 3Н2О = 2Н3РО4 Кислотный оксид + основный оксид = соль Р2О5 + ВаО = Ва3(РО4)2 Кислотный оксид + щелочь = соль + вода Р2О5 + 3Ва(ОН)2 = Ва3(РО4)2↓ + 3Н2О **Кислотный оксид + соль = соль + кислотный оксид ↑ Na2CO3 + SiO2 = Na2SiO3 + CO2↑ Применяется в производстве стекла

Выберите из перечня веществ основный оксид. Напишите для него уравнения возможных реакций с перечисленными ниже веществами: вода, оксид азота (V), серная кислота, гидроксид кальция, оксид железа (II), оксид калия, карбонат натрия

Выберите из перечня веществ кислотный оксид. Напишите для него уравнения возможных реакций с перечисленными ниже веществами: вода, оксид азота (V), серная кислота, гидроксид кальция, оксид железа (II), оксид калия, карбонат натрия

ОСНОВАНИЯ 1 Действие щелочей на индикаторы LiOH → Li+ + OH- фенолфталеиновый в щелочах малиновый Са(ОН)2→СаОН++ОН-; СаОН+ ↔Са2++ОН- универсальный синий 2 Реакция нейтрализации Н+ + ОН- = Н2О, ∆Н < 0 (можно увидеть только с индикатором) 2Fe(OH)3(н) + 6H+(сильная кислота) = 2Fe3+ + 3H2O, ∆Н < 0 3 Щелочь (р) + соль(р) = н. основание↓ + соль (р) 3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl Fe3+ + 3OH- = Fe(OH)3↓ красно-бурый осадок, ржавчина 4 Щелочь + кислотный оксид = соль + Н2О 3Са(ОН)2 + Р2О5 = Са3(РО4)2↓ + 3Н2О 3Са2+ + 6ОН- + Р2О5 = Са3(РО4)2↓ + 3Н2О

Выберите из перечня веществ основание (щелочь). Напишите для него уравнения возможных реакций с перечисленными ниже веществами: вода, оксид серы (VI), серная кислота, гидроксид калия, гидроксид железа (II), оксид кальция, хлорид меди (II)

Выберите из перечня веществ кислоту Напишите для нее уравнения возможных реакций с перечисленными ниже веществами: вода, оксид серы (VI), серная кислота, гидроксид кальция, гидроксид меди (II), оксид железа (III), силикат натрия, магний

1. Наиболее сильные основные свойства проявляет гидроксид: 1) LiOH 2) KOH 3) NaOH 4) RbOH 2. Амфотерные свойства проявляют кислородные соединения: 1) бария 2) магния 3) кальция 4) бериллия 3.К двухосновным слабым кислородсодержащим кислотам относится: 1) HNO3 2) H2S 3) H2CO3 4) H2SO4 4. К слабым кислородсодержащим кислотам относится: 1) HNО3 2) HClO4 3) H2SiO3 4)H2S

СОЛИ Все соли – ионные соединения, сильные электролиты 1 Соль (р, м, н) + кислота → соль + кислота (↓ или ↑) 2H+ + SiO32-→H2SiO3↓; СаСО3 + 2Н+→Са2+ + Н2О + СО2↑ *С солями (н, м) реагируют только сильные кислоты 2 Соль (р) + щелочь (р) → основание ↓ + соль (р или ↓) Fe3+ + 3OH- → Fe(OH)3↓ 3 Соль (р) + соль (р) → соль ↓ + соль (р) Pb2++2I-→PbI2↓(ярко-желтый осадок, не растворимый в к-тах) 4 Соль (р) + металл → соль (р) + металл ОВР Pb2+ + Zn → Zn2+ + Pb↓ *Металл вытесняет металлы, следующие за ним в ряду активности, из растворов их солей.

Выберите из перечня веществ соль Напишите для нее уравнения возможных реакций с перечисленными ниже веществами: вода, оксид серы (VI), серная кислота, гидроксид натрия, сульфат меди (II), железо, хлорид натрия, нитрат серебра

Генетическая связь неорганических веществ Металл Основный оксид Основание Соль Неметалл Кислотный оксид Кислота Соль
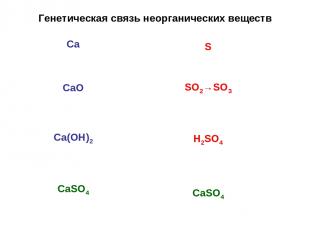
Генетическая связь неорганических веществ Са СаО Са(ОН)2 СаSО4 S SO2→SO3 H2SO4 CaSO4

Реакции ионного обмена идут без изменения заряда ионов В ионном виде не записывают слабые электролиты: Н2О, Н2СО3, HF, H2S, HNO2, H2SiO3, СН3СООН, NH4OH Н2СО3 в продуктах записывают как Н2О + СО2↑ H2SO3 в продуктах Н2О+SО2↑ NH4OH в продуктах NH3↑+H2O нерастворимые вещества (н) малорастворимые вещества (м), если они – продукты, исключение Са(ОН)2 -щелочь Оксиды – не электролиты В ионном виде записывают: растворимые вещества (р) малорастворимые вещества (м), если они – реагенты
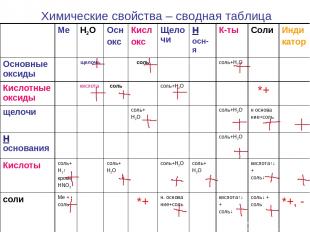
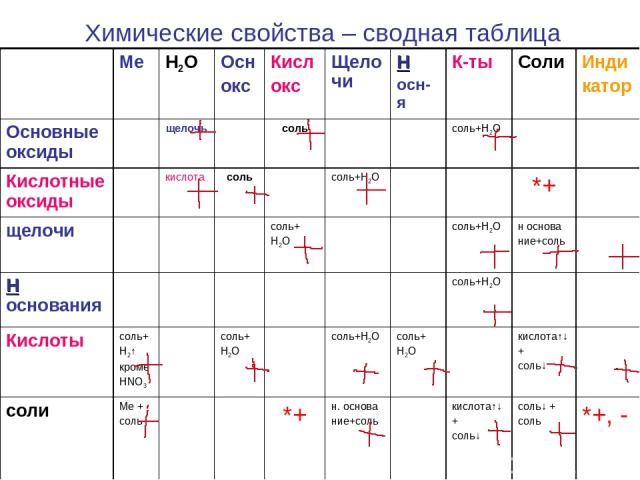
Химические свойства – сводная таблица Ме H2O Осн окс Кисл окс Щелочи Н осн-я К-ты Соли Инди катор Основные оксиды щелочь соль соль+Н2О Кислотные оксиды кислота соль соль+Н2О *+ щелочи соль+ Н2О соль+Н2О н основа ние+соль Н основания соль+Н2О Кислоты соль+ Н2↑ кроме HNO3 соль+ Н2О соль+Н2О соль+ Н2О кислота↑↓ + соль↓ соли Ме + соль *+ н. основа ние+соль кислота↑↓ + соль↓ соль↓ + соль *+, -