Презентация на тему: Органические соединения железа

Металлы. Железо. 5klass.net

Почему наш век можно назвать железным веком? Элементы и атомы, В менделеевский взятые круг, Сделали химию самой богатой И самой творческой из наук. Г. Санников

Cоединения железа. Урок химии 9 класс

Цели урока: Ознакомиться с соединениями железа и качественными реакциями на ионы железа Fе2+и Fе3+ Освоить навык определения ионов железа Развить способность эффективно использовать знаковые системы, наблюдения, сравнения; делать выводы.

Определите степени окисления железа в соединениях: FеСl3, FеSО4, Fе(ОН)2, Fе(ОН)3, Fе2(SО4)3, FеВr2

Проверь себя! Fе+3Сl3, Fе+2SО4, Fе+2(ОН)2, Fе+3(ОН)3, Fе2+3 (SО4)3, Fе+2Вr2

Природные соединения железа Fе3О4 (Fе+2О. Fе2+3О3)- магнитный железняк (магнетит) Fе2+3О3 -красный железняк (гематит) 2Fе2+3О3.3Н2О -бурый железняк Fе+2S-12 -железный колчедан (пирит)

Генетический ряд железа Fе2+ FеSО4→ Fе (ОН)2 → FеО Получение Fе(ОН)2 Цель: получить гидроксид железа (II) и охарактеризовать его. В чистую пробирку прилить 1-2 мл раствора соли FеSО4, добавить щелочь NaOH. Что наблюдаете? Рассмотреть реакцию с точки зрения ТЭД, записать уравнение реакции в трех видах.

Fе(ОН)2- зеленый осадок Проявляет основные свойства FеSО4+ 2NaOH=Na2SО4+ Fе(ОН)2↓ Fе2++SО42-+ 2Na++2OH- =2Na++SО42-+Fе(ОН)2 Fе2++ 2OH- = Fе(ОН)2 ↓ Fе(ОН)2 = FеО +Н2О FеО- основный оксид

Генетический ряд железа Fе3+ FеСl3→ Fе(ОН)3 → Fе2О3 Получение Fе(ОН)3 Цель: получить гидроксид железа (III) и охарактеризовать его. 2.В чистую пробирку прилить 1-2 мл. раствора соли FеСl3, добавить щелочь NaOH. Что наблюдаете? Рассмотреть реакцию с точки зрения ТЭД, записать уравнение реакции в трех видах.

Fе(ОН)3- бурый осадок Проявляет амфотерные свойства FеСl3+ 3NaOH=3NaСl + Fе(ОН)3↓ Fе3++3Сl- + 3Na++3OH-=3Na++ 3Сl-+ Fе(ОН)3 Fе3++ 3OH- = Fе(ОН)3 ↓ 2Fе(ОН)3 = Fе2О3+3H2O Fе2О3 – амфотерный оксид

Качественная реакция на ион Fе2+ Качественная реакция на ион Fе2+ 1.Реактив – красная кровяная соль К3[Fе(СN)6 ] Результат – синий осадок( турнбулева синь) 3FeSO4+2К3[Fе+3(СN)6 ]→Fe3 [Fе(СN)6 ]2 +3К2SO4
![Качественная реакция на ион Fе3+ Реактив – желтая кровяная соль К4[Fе(СN)6] Резу Качественная реакция на ион Fе3+ Реактив – желтая кровяная соль К4[Fе(СN)6] Резу](https://fs3.ppt4web.ru/images/132073/183740/310/img12.jpg)
Качественная реакция на ион Fе3+ Реактив – желтая кровяная соль К4[Fе(СN)6] Результат – синий осадок(берлинская лазурь) 4FeCl3+К4[Fе+2(СN)6 ] →Fe4[Fе(СN)6 ]3 + 12KCl

Качественная реакция на ион Fе3+ 2. Реактив – роданид калия КСNS Результат – интенсивно-красный цвет FeCl3 +3KCNS →Fe(CNS)3 + 3KCl

Техническое значение соединений железа. Fе+2SО4 . 7Н2О – железный купорос. Применяют для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины. Fе+3Сl3 – хлорид железа (III). Применяют для очистки воды, в качестве протравы при крашении тканей. Fе2+3(SО4)3.9Н2О – сульфат железа(III). Применяют при очиcтке воды, в качестве растворителя в гидрометаллургии. Сплавы железа. Чугун (Fе и 2-4,5%С) Сталь (Fе и >2%С)

Применение стали

Булат – старинная узорчатая твердая сталь для клинков.
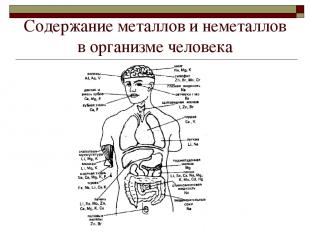
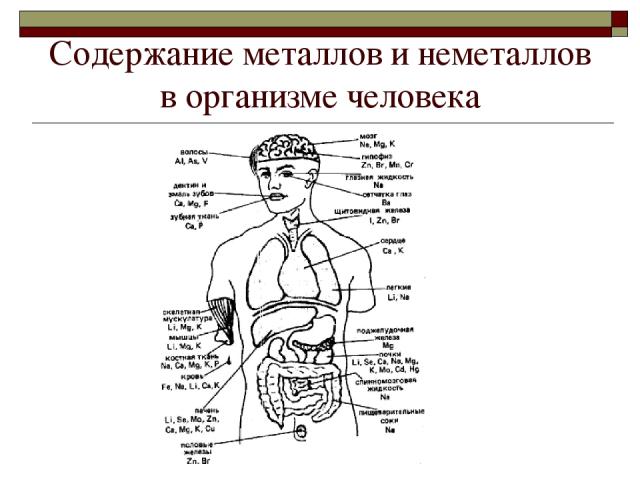
Cодержание металлов и неметаллов в организме человека
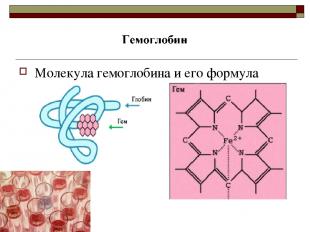
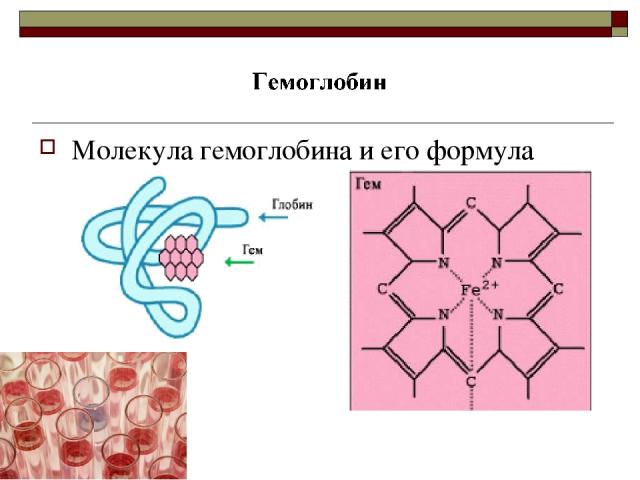
Молекула гемоглобина и его формула
Почему наш век можно назвать железным веком? Я научился… Я узнал… Мне понравилось…

Итоги урока. 8-9 баллов- оценка 5 5-7 баллов – оценка 4 4 балла – оценка 3

Почему наш век можно назвать железным веком? Написать эссе, миниатюру, сказку Сделать подборку текстовых материалов о соединениях металла из Интернет - источников. Создать коллекцию цифровых фотографий о соединениях металла и их применении.












![Качественная реакция на ион Fе2+ Качественная реакция на ион Fе2+ 1.Реактив – красная кровяная соль К3[Fе(СN)6 ] Результат – синий осадок( турнбулева синь) 3FeSO4+2К3[Fе+3(СN)6 ]→Fe3 [Fе(СN)6 ]2 +3К2SO4 Качественная реакция на ион Fе2+ Качественная реакция на ион Fе2+ 1.Реактив – красная кровяная соль К3[Fе(СN)6 ] Результат – синий осадок( турнбулева синь) 3FeSO4+2К3[Fе+3(СN)6 ]→Fe3 [Fе(СN)6 ]2 +3К2SO4](https://fs3.ppt4web.ru/images/132073/183740/640/img11.jpg)
![Качественная реакция на ион Fе3+ Реактив – желтая кровяная соль К4[Fе(СN)6] Результат – синий осадок(берлинская лазурь) 4FeCl3+К4[Fе+2(СN)6 ] →Fe4[Fе(СN)6 ]3 + 12KCl Качественная реакция на ион Fе3+ Реактив – желтая кровяная соль К4[Fе(СN)6] Результат – синий осадок(берлинская лазурь) 4FeCl3+К4[Fе+2(СN)6 ] →Fe4[Fе(СN)6 ]3 + 12KCl](https://fs3.ppt4web.ru/images/132073/183740/640/img12.jpg)