Презентация на тему: Основные типы химической связи

Автор презентации – Боровикова Марина Васильевна, учитель химии ГБОУ лицей № 265 Санкт-Петербурга ХИМИЧЕСКАЯ СВЯЗЬ 900igr.net

Химическая связь – совокупность сил, обуславливающих взаимодействие атомов в химических соединениях
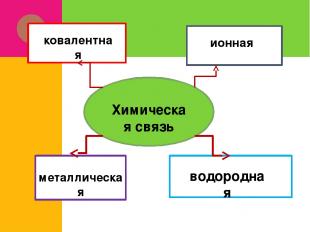
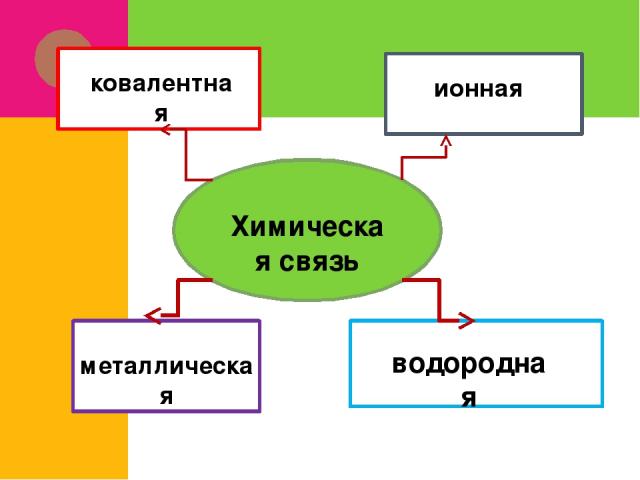
Химическая связь ковалентная ионная металлическая водородная

Ковалентная связь Это связь, которая возникает за счет образования между атомами общих электронных пар
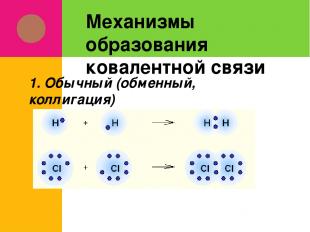
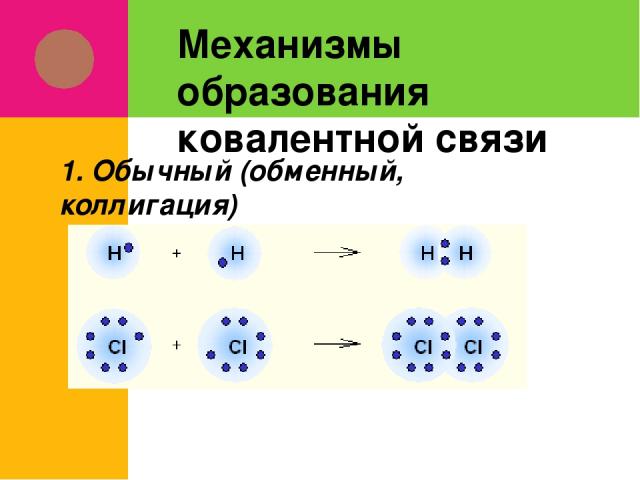
Механизмы образования ковалентной связи 1. Обычный (обменный, коллигация)

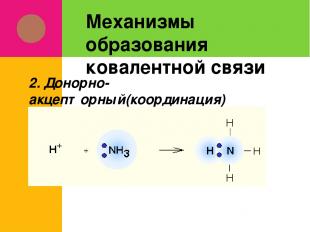
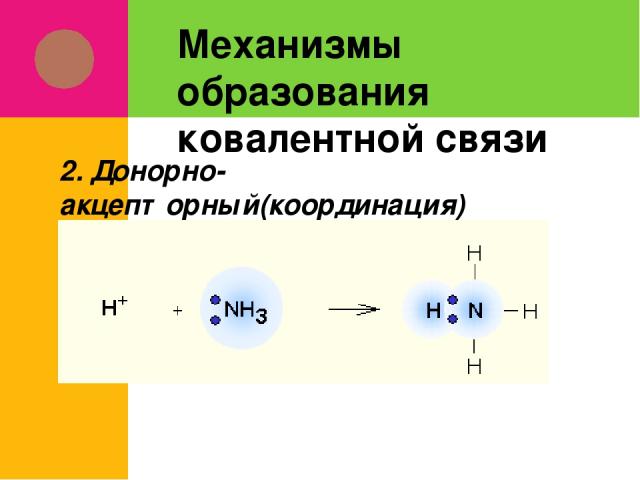
Механизмы образования ковалентной связи 2. Донорно-акцепторный(координация)

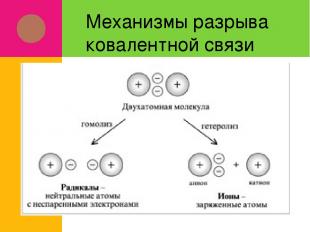
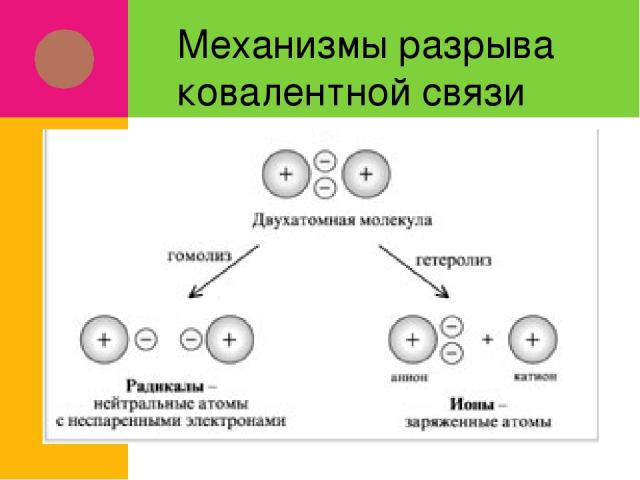
Механизмы разрыва ковалентной связи
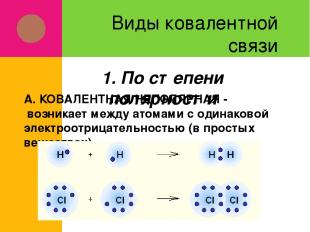
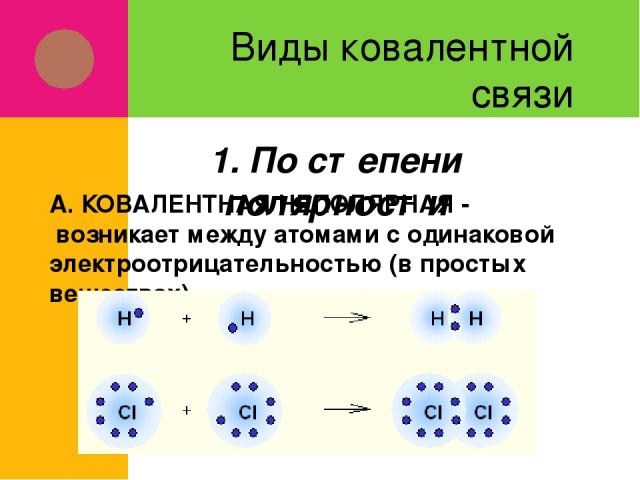
Виды ковалентной связи А. КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ - возникает между атомами с одинаковой электроотрицательностью (в простых веществах) 1. По степени полярности

Виды ковалентной связи Б. КОВАЛЕНТНАЯ ПОЛЯРНАЯ - возникает между атомами с различной электроотрицательностью, разница ЭО
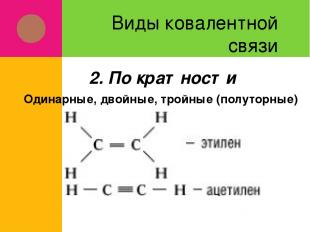
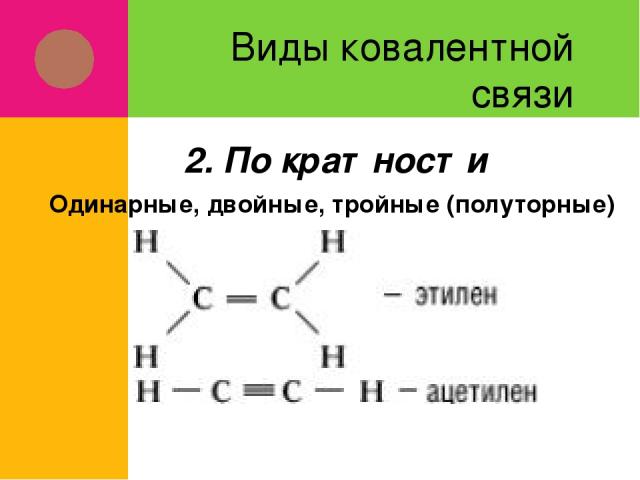
Виды ковалентной связи Одинарные, двойные, тройные (полуторные) 2. По кратности

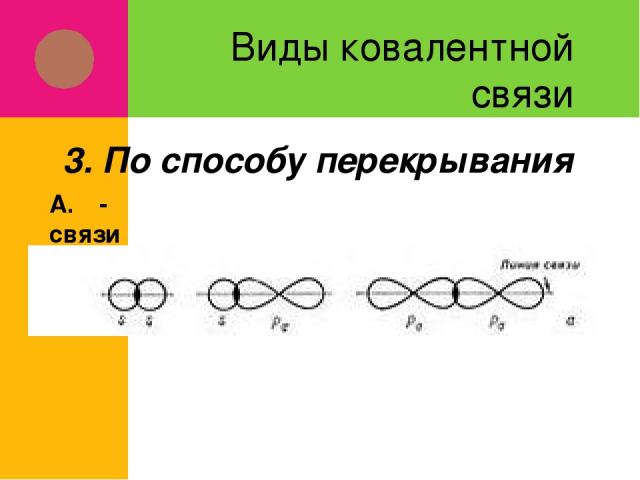
Виды ковалентной связи А. Ϭ-связи 3. По способу перекрывания
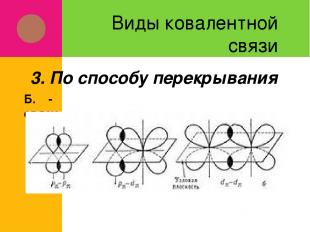
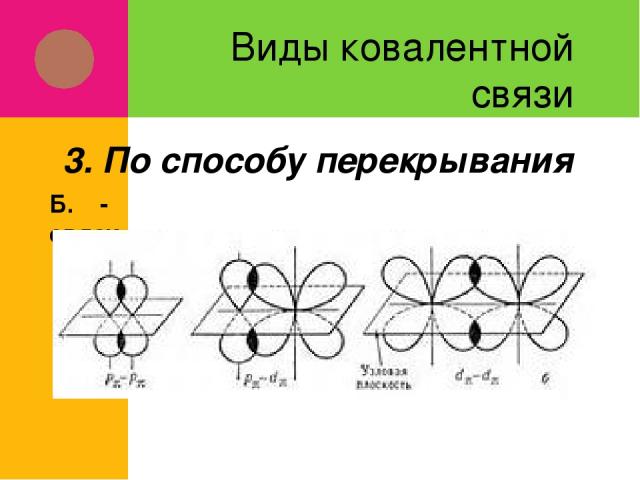
Виды ковалентной связи Б. π-связи 3. По способу перекрывания

Параметры ковалентной связи Длина связи – это расстояние между центрами взаимодействующих атомов Энергия связи – энергия, которая выделяется при ее образовании (или поглощается при разрыве). Измеряется в кДж/моль

Параметры ковалентной связи Валентный угол – угол между центрами взаимодействующих атомов Полярность связи (определяется разницей в ЭО)– характеризуется дипольным моментом µ=q·r
Свойства ковалентной связи насыщаемость направленность

насыщаемость Атомы могут образовывать определенное число ковалентных химических связей (валентность) Валентность определяется: числом неспаренных электронов числом неподеленных электронных пар (могут участвовать в донорно-акцепторном взаимодействии) числом свободных орбиталей
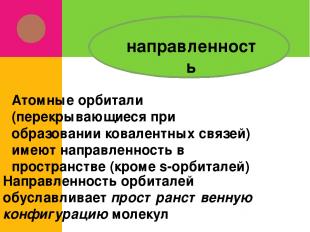
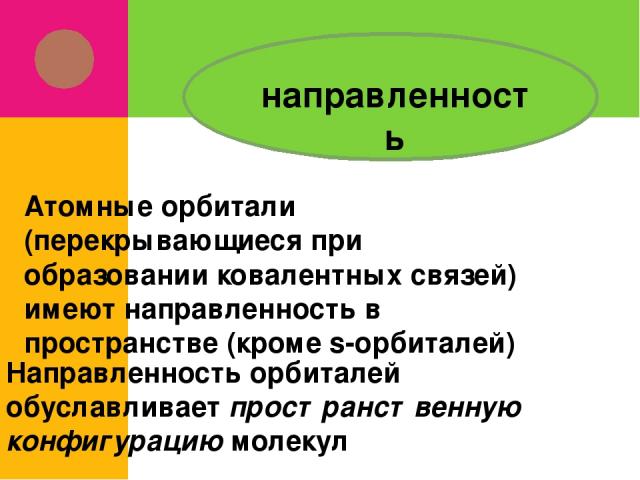
направленность Атомные орбитали (перекрывающиеся при образовании ковалентных связей) имеют направленность в пространстве (кроме s-орбиталей) Направленность орбиталей обуславливает пространственную конфигурацию молекул

Ионная химическая связь Возникает между типичными металлами и неметаллами (разница в электроотрицательности ˃ 2, элементы I, II групп + элементы VI, VII групп)
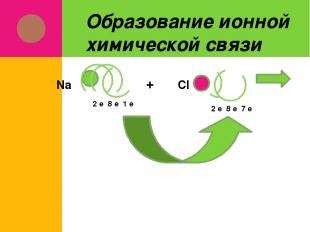
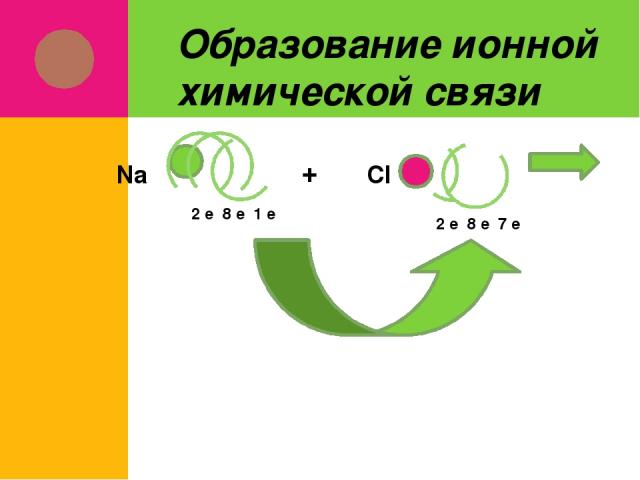
Образование ионной химической связи 2 е 8 е 1 е Na + Cl 2 е 8 е 7 е
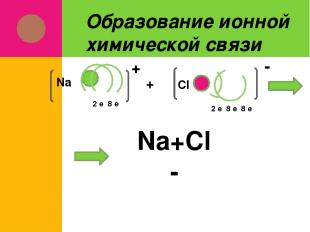
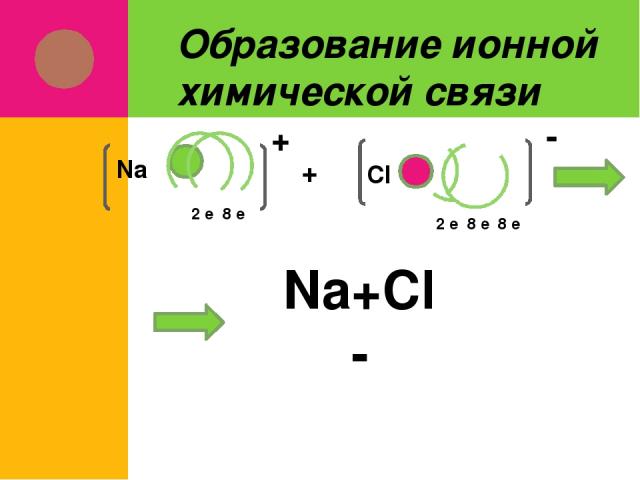
Образование ионной химической связи 2 е 8 е Na + Cl 2 е 8 е 8 е + - Na+Cl- Na+Cl-

Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов называются ионами Связь между ионами называется ионной химической связью Соединения, в которых присутствует ионная химическая связь, называются ионными соединениями

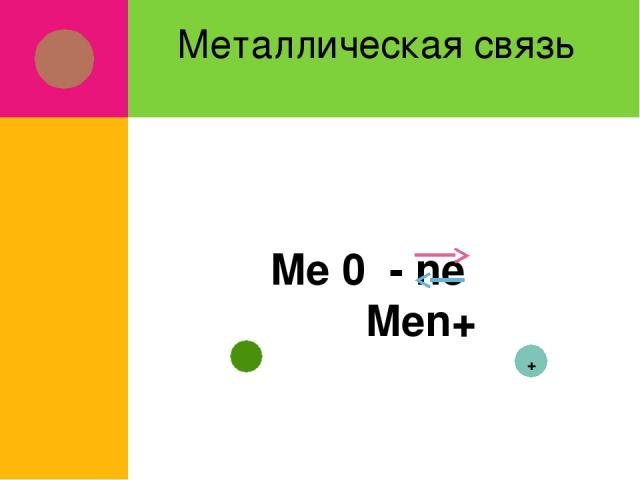
Металлическая связь Me 0 - ne Men+ +
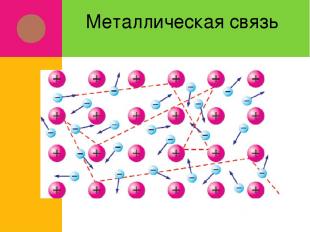
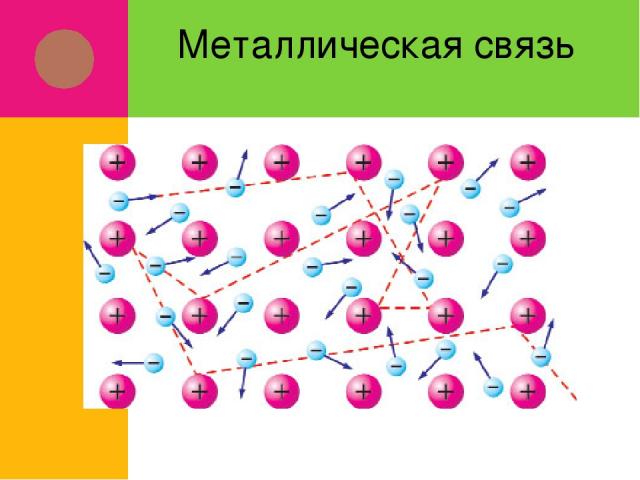
Металлическая связь

Оторвавшиеся электроны перемещаются от одного иона к другому, связывая их в единое целое Связь в металлах между ионами посредством обобществленных электронов называется металлической Металлическая связь характерна для металлов и их сплавов в твердом и жидком состоянии
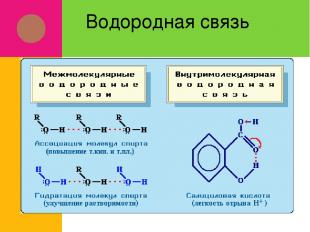
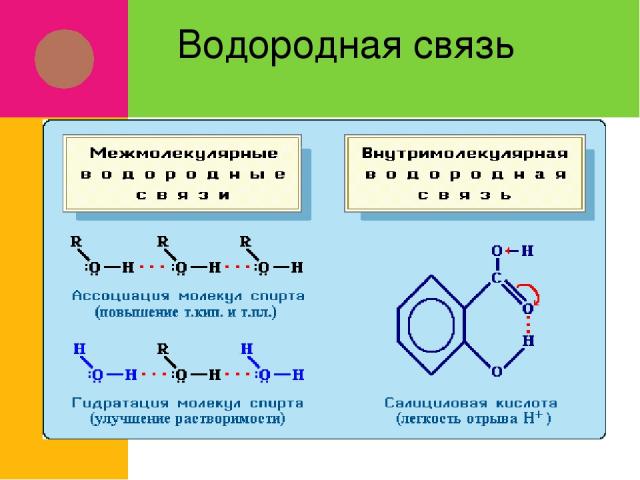
Водородная связь