Презентация на тему: Основные понятия и законы химии

Курс: «Неорганическая химия» Лектор: Шарлай Екатерина Валерьевна (ауд. 201/1а) Иллюстрации к лекциям можно скачать по адресу: inorgchem.susu.ac.ru, в разделе «Студенту» Объем курса (на один семестр): лекции - 54 ч, практики – 36 ч, лабораторные - 108 ч, сам. работа - 90 ч 900igr.net
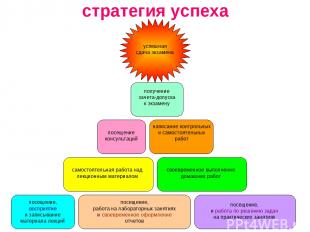
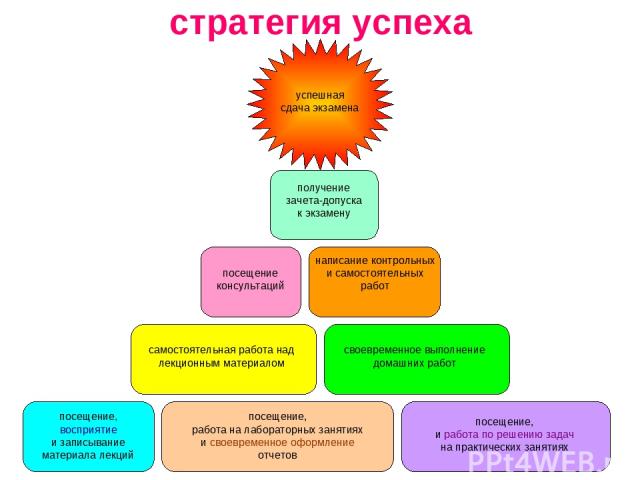
стратегия успеха посещение, работа на лабораторных занятиях и своевременное оформление отчетов посещение, восприятие и записывание материала лекций посещение, и работа по решению задач на практических занятиях самостоятельная работа над лекционным материалом своевременное выполнение домашних работ посещение консультаций написание контрольных и самостоятельных работ получение зачета-допуска к экзамену успешная сдача экзамена

правила поведения Постараться не опаздывать Подготовить доску перед занятием Поздороваться с лектором Не шуметь и не разговаривать во время занятий

рекомендуемая литература 1. Н.Л. Глинка. Общая химия. 2. Н.С. Ахметов. Общая и неорганическая химия. 3. Я.А. Угай. Общая и неорганическая химия. 4. Н.В. Коровин. Общая химия. 5. К. Хаускрофт, Э. Констебл. Современный курс общей химии. 6. Д. Шрайвер, П. Эткинс. Неорганическая химия. 7. Н. Гринвуд, А. Эрншо. Химия элементов 8. Неорганическая химия. Под ред. Третьякова Ю.Д.

Тема № 1 ОСНОВНЫЕ ЗАКОНЫ И ПОНЯТИЯ ХИМИИ (в лекциях использованы материалы преподавателей химического факультета и факультета наук о материалах МГУ Ю.Д. Третьякова, А.В. Шевелькова, В.В. Еремина, А.Я. Борщевского, Е.А. Гудилина, В.В. Загорского)
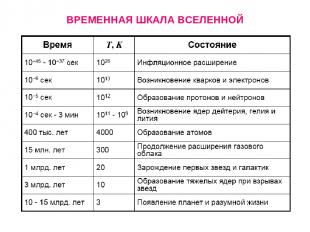
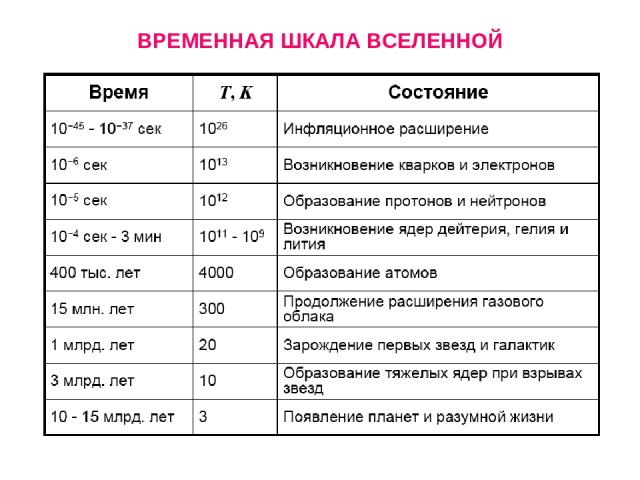
ВРЕМЕННАЯ ШКАЛА ВСЕЛЕННОЙ
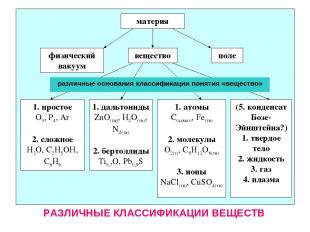
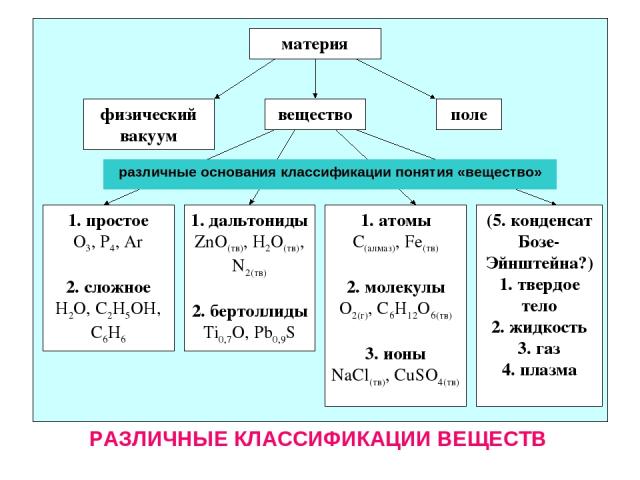
материя вещество поле физический вакуум 1. простое О3, Р4, Ar 2. сложное H2O, C2H5OH, C6H6 1. дальтониды ZnO(тв), H2O(тв), N2(тв) 2. бертоллиды Ti0,7O, Pb0,9S 1. атомы С(алмаз), Fe(тв) 2. молекулы О2(г), С6Н12О6(тв) 3. ионы NaCl(тв), CuSO4(тв) (5. конденсат Бозе-Эйнштейна?) 1. твердое тело 2. жидкость 3. газ 4. плазма различные основания классификации понятия «вещество» РАЗЛИЧНЫЕ КЛАССИФИКАЦИИ ВЕЩЕСТВ

Основы химии: 1) атомно-молекулярное учение 2) стехиометрические законы закон сохранения массы закон сохранения энергии закон эквивалентов закон постоянства состава и свойств вещества закон кратных отношений 3) газовые законы закон Авогадро законы Бойля - Мариотта и Гей-Люссака уравнение Менделеева – Клапейрона 4) периодический закон Д.И. Менделеева 5) квантовая теория строения вещества

СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ Михаил Васильевич Ломоносов Юлиус Роберт Майер Джеймс Прескотт Джоуль Герман Людвиг Фердинанд Гельмгольц Антуан Лоран Лавуазье
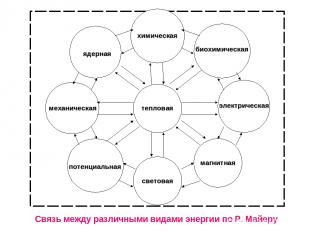
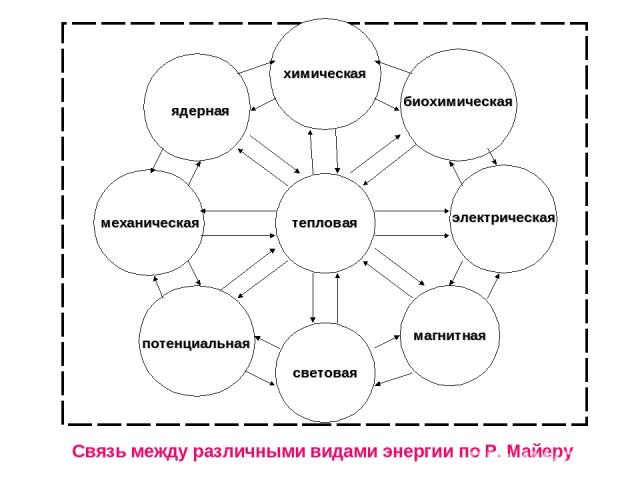
тепловая химическая световая механическая электрическая ядерная потенциальная биохимическая магнитная Связь между различными видами энергии по Р. Майеру

Жозеф-Луи Пруст Иеремия Вениамин Рихтер Клод-Луи Бертолле СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ

СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ Жозеф-Луи Пруст Клод-Луи Бертолле Джон Дальтон Иеремия Вениамин Рихтер

ГАЗОВЫЕ ЗАКОНЫ Ян Баптист ван Гельмонт Роберт Бойль Эдм Мариотт Жозеф-Луи Гей-Люссак

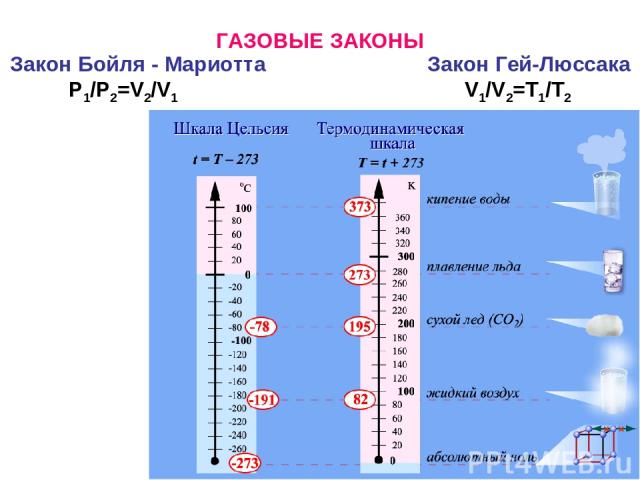
ГАЗОВЫЕ ЗАКОНЫ Закон Бойля - Мариотта Закон Гей-Люссака P1/P2=V2/V1 V1/V2=T1/T2

ГАЗОВЫЕ ЗАКОНЫ Закон Дальтона р=рa+pb+… px=(nx/nΣ)·pΣ Закон Бойля - Мариотта Закон Гей-Люссака P1/P2=V2/V1 V1/V2=T1/T2 P1V1/T1=P2V2/T2 Закон Авогадро Уравнение Менделеева – Клапейрона (уравнение состояния идеального газа) PV=nRT Молекулярную массу газа можно вычислить несколькими способами. 1. При н.у. М=D·22,4, где D – плотность газа в г/л. 2. М=2·DH2 M=29·Dвозд, где DH2, Dвозд – относительная плотность газа по водороду или воздуху. В расчете молярной массы воздуха используется формула Мср=М1φ1+М2φ2+…+Mnφn, где φ – объемная или мольная доля компонента газовой смеси.