Презентация на тему: Классификация химических реакций, протекающих в организме человека

Классификация химических реакций, протекающих в организме человека Реакционная способность и механизм

Изучение общих закономер-ностей реакционной способ-ности биоорганических соединений является осно-вой понимания механизмов их биологического функцио-нирования

Классификация химических реакций 1. По результату химического взаимодействия. Различают реакции замещения, присоединения, элиминирования, окисления, восстановления, кислотно-основные взаимодействия, лигандообменные процессы. 2. По механизму реакции, определяемому природой активных частиц, ведущих химический процесс. Выделяют реакции электрофильного, нуклеофильного замещения и присоединения, свободнорадикальные процессы. 3. По числу молекул, принимающих участие в элементарном акте (моно-, ди-, тримолекулярные реакции).

В ходе биохимических и химических процессов превращению подвергается не вся молекула, а лишь какая-либо часть (фрагмент) достаточно сложной структуры. Отсюда вытекает понятие реакционного центра. Отдельные части молекулы могут выполнять роль реакционного центра в совершенно разных реакциях, реагировать с определенными активными частицами и реагентами.

Понятие реагента и субстрата Реагентом считают соединение, из которого образуется актив-ная частица. Субстратом называют молеку-лу, которая превращается в хо-де химического процесса, пре-доставляя для взаимодействия атомы С, Р, N и др.

Реагент, который генерирует в ходе реакции электрофильные частицы (Е+), называется электрофильным. Реагент, который предоставляет отрицательно заряженные частицы (Nu-), называется нуклеофильным. Активные частицы, имеющие неспа-ренные или валентные электроны, называются свободными радика-лами (R•).

Типы разрыва связи Свободнорадикальные частицы образуются при гомолитическом разрыве ковалентной связи Е •|• Y → E• + Y • Электрофильные и нуклеофильные реагенты образуются при гетероли-тическом разрыве ковалентной связи Е | •• Y → E+ + Y -

Природа активных частиц Свободнорадикальные частицы (имеют неспаренный или валентный электрон) (ОH•, Br •,Cl •, CH3 •, RO2 •и т.д.) Электрофильные частицы (имеют не заполненный электронный уровень) NO2+,SO3H+,CH3+, CH3 CO+, Сl+, Br+ Нуклеофильные частицы (имеют неподеленную электронную пару на внешнем электронном уровне или являются анионом) ОН-, OCH3, NH3, NH2-, CN- и др.

Классификация органических реакций 1. Реакции замещения (Substitution) SR – радикального замещения SЕ – электрофильного замещения SN – нуклеофильного замещения 2. Реакции присоединения (Addition) АR – радикального присоединения АЕ – электрофильного присоединения АN – нуклеофильного присоединения

Классификация органических реакций 3. Реакции элиминирования (отщепления) (eliminination) (E) 4. Окислительно-восстановительные реакции (Oxidation-reduction) (реакции эпоксидирования, гидроксилирования) 5. Кислотно-основные взаимодействия 6. Лигандообменные процессы 7. Перегруппировки

Реакции электрофильного присоединения Субстратом реакций AE являются алкены, алкины, реакции протекают по реакционному центру, представляю-щему собой кратную связь. [ Н+ ] НООС- СН=СН- СООН + НОН ─→ Фумаровая кислота [ О ] НООС- СН – СН2- СООН → НООС-С-СН2СООН | || ОН О Яблочная кислота Щавелевоуксусная
![Пример реакции АЕ СООН [ Н+ ] НООС-СН2 –С=СН-СООН + НОН ─→ Цис-аконитовая кислот Пример реакции АЕ СООН [ Н+ ] НООС-СН2 –С=СН-СООН + НОН ─→ Цис-аконитовая кислот](https://fs1.ppt4web.ru/images/95289/122046/310/img11.jpg)
Пример реакции АЕ СООН [ Н+ ] НООС-СН2 –С=СН-СООН + НОН ─→ Цис-аконитовая кислота СООН НООС-СН2 – CH - СН-СООН ОН Изолимонная кислота

Пример реакции АЕ СН3-(СН2)7 -СН=СН- (СН2)7-СООН + Br2 → Олеиновая кислота СН3-(СН2)7 -СН─СН- (СН2)7-СООН | | Br Br

Механизм реакций АЕ Образование электрофильной частицы HOBr → OH- + Br+ (E+) 2. Образование пи-комплекса СН2=СН2 + Br+ → СН2=СН2 → СН2 ─ СН2 Br+ Br+ пи-комплекс сигма-комплекс СН2─СН2 катион бромония | | Br OH

Механизм реакций АЕ Реакция бромирования 2. Образование пи-комплекса СН2=СН2 + Br2 (Br+-Br-) → СН2=СН2 Br+-Br- пи-комплекс → СН2 ─ СН2 + Br- → СН2─СН2 Br+ | | сигма-комплекс - Br Br катион бромония 1,2-дибромэтан

Реакция гидратации алкенов (с водой) Является наиболее важной в медико-биологическом отношении. Реакция проходит в присутствии минеральных кислот Н2SO4, H3PO4, присутствующих в организме НОН СН2=СН2 + Н+ →СН3-СН2+ карбкатион + СН3-СН2-О-Н → СН3-СН2-ОН Н -Н+ (возврат катализатора)

Правило Марковникова Нессиметричные алкены. Реакция гидрогалогенирования, гидратации протекает таким образом, что протон присоединяется к наиболее гидрированному атому углерода. Акролеин. Реакция протекает против правила Марковникова, что связано с мезомерным эффектом карбонильной группы

Скорость и направление реакций АЕ Определяется двумя факторами: статическим и динамическим. Статический фактор связан с электронным эффектом заместителей, а динамический – с устойчивостью образующихся карбокатионов. СН2=С-СН3> СН3- СН=СН-СН3> СН2=С-СН3 СН3 СН2=СН2 Электронодоноры увеличивают, а электроно- акцепторы уменьшают стабильность карбкатионов (сигма – комплексов) -СН3, -СН2-СН3; (электронодоноры) + -СООН; -СF3; -NO2; -С≡N; -N(CH3)3 (электроноакцепторы)

Особенности присоединения к сопряженным диенам Реакция идет по двум направлениям (1-2 и 1,4 присоединение), что связано с эффектом сопряжения в этих структурах. СН2=СН-СН=СН2 + НBr → СН2 - СН-СН=СН2 + СН2 – СН=СН - СН2 | | | | Br Br Br Br 3,4-дибром-бутен-1 1,4-дибром-бутен-2 (20%) (80%)

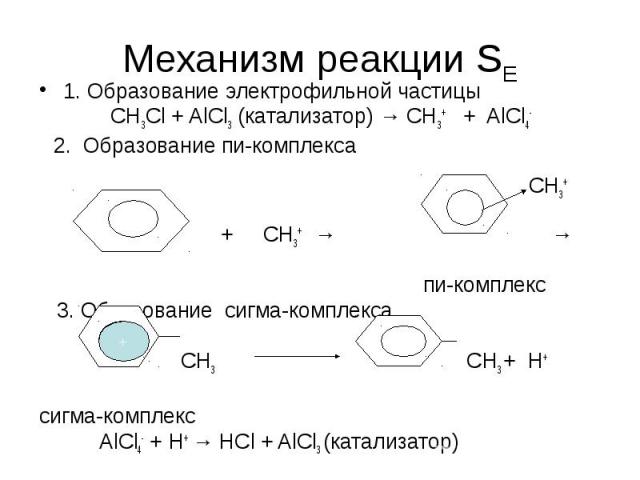
Реакции электрофильного замещения (SE) Реакция образования электрофильной частицы 1.1 Реакция алкилирования СН3Сl + AlCl3 → CH3+ + AlCl4- 1.2 Реакция ацилирования СН3СOCl + AlCl3 → CH3CO+ + AlCl4- 1.3 Реакция нитрования НNO3+2 H2SO4→ NO2+ + H3O+ + 2 HSO3- 1.4 Реакция сульфирования Н2SO4 → HSO3+ + OH- 3
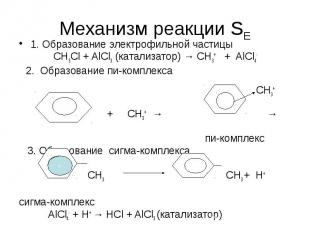
Механизм реакции SЕ 1. Образование электрофильной частицы СН3Сl + AlCl3 (катализатор) → CH3+ + AlCl4- 2. Образование пи-комплекса СН3+ + СН3+ → → пи-комплекс 3. Образование сигма-комплекса СН3 СН3 + Н+ сигма-комплекс AlCl4- + H+ → HCl + AlCl3 (катализатор)











![Реакции электрофильного присоединения Субстратом реакций AE являются алкены, алкины, реакции протекают по реакционному центру, представляю-щему собой кратную связь. [ Н+ ] НООС- СН=СН- СООН + НОН ─→ Фумаровая кислота [ О ] НООС- СН – СН2- СООН → НОО… Реакции электрофильного присоединения Субстратом реакций AE являются алкены, алкины, реакции протекают по реакционному центру, представляю-щему собой кратную связь. [ Н+ ] НООС- СН=СН- СООН + НОН ─→ Фумаровая кислота [ О ] НООС- СН – СН2- СООН → НОО…](https://fs1.ppt4web.ru/images/95289/122046/640/img10.jpg)
![Пример реакции АЕ СООН [ Н+ ] НООС-СН2 –С=СН-СООН + НОН ─→ Цис-аконитовая кислота СООН НООС-СН2 – CH - СН-СООН ОН Изолимонная кислота Пример реакции АЕ СООН [ Н+ ] НООС-СН2 –С=СН-СООН + НОН ─→ Цис-аконитовая кислота СООН НООС-СН2 – CH - СН-СООН ОН Изолимонная кислота](https://fs1.ppt4web.ru/images/95289/122046/640/img11.jpg)