Презентация на тему: Классификация химических реакций 8 класс

Классификация химических реакцийМаланина Елена АлексеевнаУчитель химииМОУ Большевяземская гимназия, р.п. Большие Вяземы, Одинцовский район, Московская область

Химические реакции - это процессы, в результате которых изодних веществобразуютсядругие, отличающиесяот них по составу и строению

КлассификацияПо числу и составу реагирующих веществПо изменению степени окисления химических элементов, образующих веществаПо тепловому эффектуПо агрегатному состоянию реагирующих веществПо участию катализатораПо направлению

По числу и составу реагирующих веществРеакции, идущие без изменения состава веществРеакции, идущие с изменением состава вещества

По изменению степени окисленияОкислительно-восстановительныеРеакции, идущие без изменения степеней окисления химических элементов

По тепловому эффектуЭкзотермическиеЭндотермические

По агрегатному состоянию реагирующих веществГомогенныеГетерогенные

По участию катализатораКаталитическиеНекаталитические

По направлениюНеобратимыеОбратимые

Получение аллотропных модификаций C (графит) C (алмаз)

С изменением составаСоединенияРазложенияЗамещенияОбмена

Реакции соединения – из двух и более веществ образуется одно более сложное2H2 + O2 2H2O2Na + Cl2 2NaClРешить:Ca + O2 Na + SH2 + Br2

Реакции разложения – из одного вещества образуется два и более2HgO 2Hg + O22KNO3 2KNO2 + O2Решить:Fe(OH)2MgCO3

Реакции замещения – атомы простого вещества замещают атомы в сложном веществеMg + 2HCl MgCl2 + H2Zn + CuSO4 ZnSO4 + CuРешить:Zn + H2SO4 CuO + H2

Реакции обмена – вещества обмениваются своими составными частямиCO2+Ca(OH)2 CaCO3 +H2OK2S + 2HCl H2S + 2KClNaOH + HNO3 NaNO3 + H2OРешить:KOH + HClAgNO3 + HClMgCl2 + K2CO3

Окислительно-восстановительные реакции 0 0 +4 -2 C + O2 CO2 0 +4 C – 4e Cвосстановитель процесс окисления 0 - 2 O2 + 4e 2Oокислитель процесс восстановленияРешить: Mg + O2

Реакции протекающие без изменения степени окисления + -2 + -2 + -2 +Li2O + H2O 2LiOH +2 +4 -2 +2 -2 +4 -2CaCO3 CaO + CO2Решить:Na2O + H2OCu(OH)2

Экзотермические - реакции протекающие с выделением теплоты 4P + 5O2 2P2O5 + QCH4+2O2 CO2+2H2O + Q

Эндотермические – реакции протекающие с поглощением теплотыN2 +O2 2NO – QH2 + I2 2HI – Q

Гомогенные – реакции в которых исходные вещества и продукты реакции находятся в одном агрегатном состоянииH2 (г) + F2(г) 2HF(г)Fe(т) + S(т) FeS (т)

Гетерогенные - реакции в которых исходные вещества и продукты реакции находятся в разных агрегатных состоянияхCa(т) + 2H2O(ж) Ca(OH)2(р-р) +H2(г)

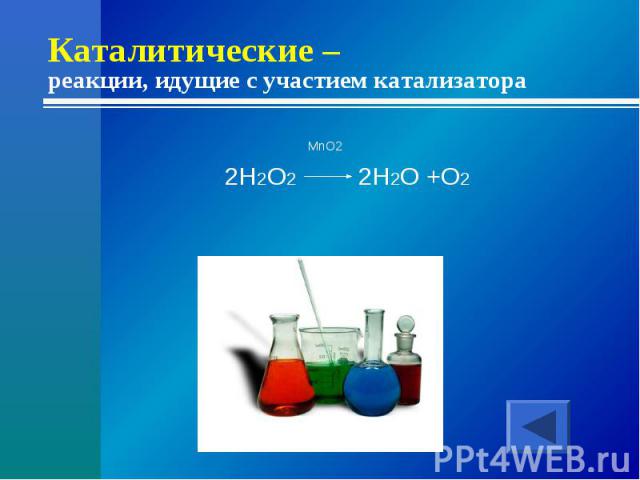
Каталитические – реакции, идущие с участием катализатора MnO22H2O2 2H2O +O2
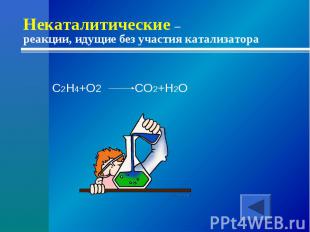
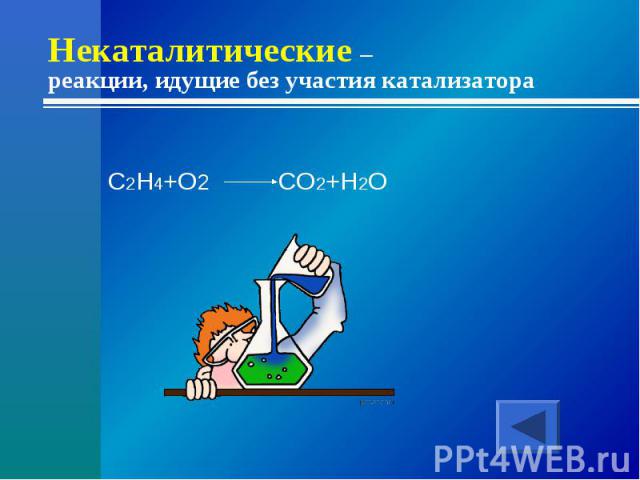
Некаталитические – реакции, идущие без участия катализатораC2H4+O2 CO2+H2O

Обратимые – реакции в данных условиях протекают одновременно в двух направленияхC2H4 + H2 C2H6N2 + 3H2 2NH3

Необратимые – реакции в данных условиях протекают только в одном направленииH2SO4+BaCl2 BaSO4 + 2HCl2Na+2H2O 2NaOH+H2

Составим характеристику процесса синтеза аммиака 0 0 Fe – 3 + N2 (г) + 3H2 (г) NH3 (г) + Q Реакция: Соединения Окислительно-восстановительная Экзотермическая Обратимая Каталитическая Гетерогенная

Вывод:Классификация химических реакций условна.Ученые договорились разделить реакции на определенные типы по выделенным признакамБольшинство реакций можно отнести к разным типам