Презентация на тему: Классификация химических реакций

Классификация химических реакций По числу и составу реагирующих и образующихся веществ По тепловому эффекту По агрегатному состоянию реагирующих и образующихся веществ По направлению По наличию катализатора По изменению степени окисления элементов По механизму протекания По виду энергии, инициирующей реакцию

Цель урока Рассмотреть особенности строения атомов хрома и марганца, на основании строения электронных оболочек предсказать возможные степени окисления этих элементов в соединениях. Отработать умения составлять уравнения окислительно-восстановительных реакций методом электронного баланса. Выяснить влияние среды на окислительные свойства перманганат-иона. Воспитывать навыки самооценки знаний, совместной работы в группах, умения логически мыслить, наблюдательность.
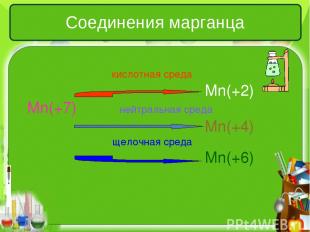
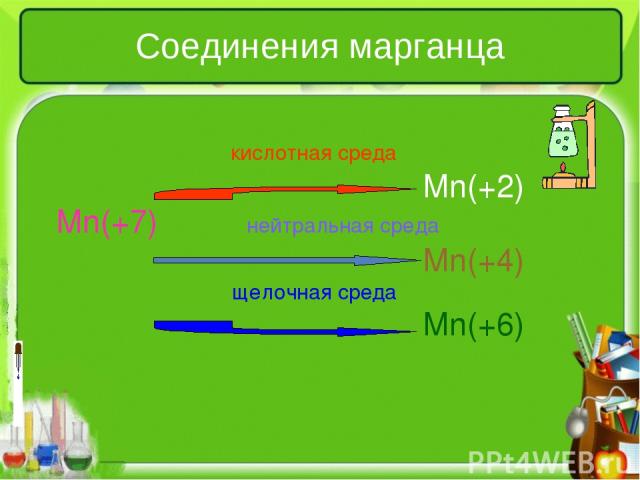
Соединения марганца кислотная среда Mn(+2) Mn(+7) нейтральная среда Mn(+4) щелочная среда Mn(+6)
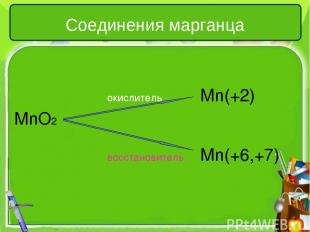
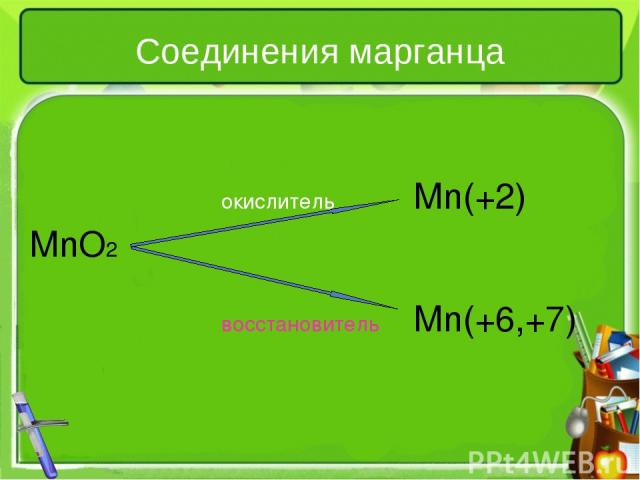
Соединения марганца окислитель Mn(+2) MnO2 восстановитель Mn(+6,+7)
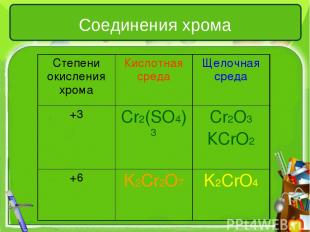
Соединения хрома Степени окисления хрома Кислотная среда Щелочная среда +3 Cr2(SO4)3 Cr2O3 КCrO2 +6 K2Cr2O7 K2CrO4





Внимание! Упражнение! KMnO4+KNO2+H2SO4= KMnO4+KNO2+H2O= KMnO4+KNO2+КОН= MnO2+KNO2+H2SO4= MnO2+KNO3+KOH= Cr2O3+KClO3+KOH= KCrO2+Br2+KOH= K2CrO4 + H2O + H2S= Cr2(SO4)3+KMnO4+H2O= K2Cr2O7+HI+H2SO4=
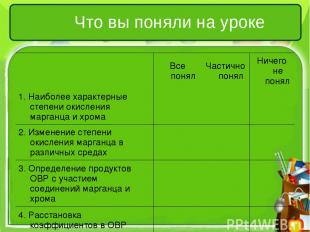
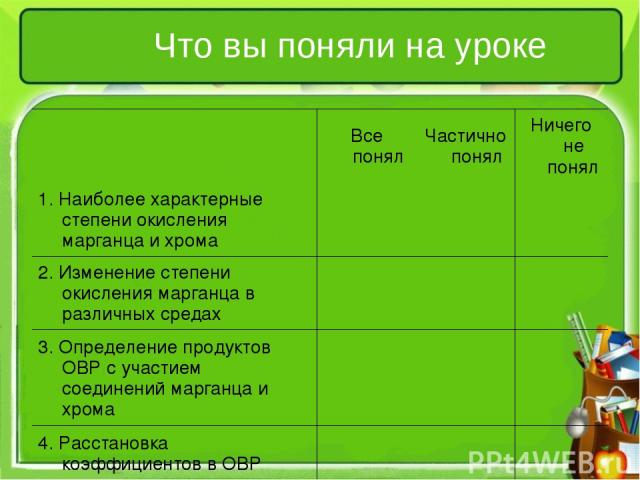
Что вы поняли на уроке Все понял Частично понял Ничего не понял 1. Наиболее характерные степени окисления марганца и хрома 2. Изменение степени окисления марганца в различных средах 3. Определение продуктов ОВР с участием соединений марганца и хрома 4. Расстановка коэффициентов в ОВР методом электронного баланса

Спасибо за работу

Список источников Настольная книга учителя. Химия. 11 класс: В 2 ч. Ч. I/ О.С.Габриелян, Г.Г.Лысова, А.Г.Введенская. – М.: Дрофа, 2003. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ О.С.Габриелян, Г.Г.Лысова. – М.: Дрофа, 2008. Изображения по ТБ: http://eco.solovschool.edusite.ru/images/p68_pres_him3.jpg http://vh2.wt4013306.hosting10.tomsknet.ru/wp-content/uploads/2016/01/55.jpg http://mypresentation.ru/documents/e64066f3086e57f51886ef1d8f370fee/img5.jpg http://900igr.net/datai/khimija/Fizicheskie-i-khimicheskie-svojstva-kislot/0020-021-Blagodarju-za-urok.jpg