Презентация на тему: Химические свойства одноосновных (предельных) карбоновых кислот

"Химические свойства одноосновных (предельных) карбоновых кислот"

На уроке мы должны: изучить химические свойства одноосновных карбоновых кислот на примере уксусной кислоты; специфические свойства карбоновых кислот; вспомнить взаимное влияние атомов в молекулах карбоновых кислот; развивать логическое мышление, умение обобщать и делать выводы.

Тест «5» за 5 минут 1.Двухосновной кислотой является А) лимонная Б) яблочная В)щавелевая Г) акриловая 2.К ароматическим кислотам относится А) щавелевая Б)масляная В) фталевая Г)молочная 3.Малоновая и метандикарбоновая кислота являются А) изомерами Б)гомологами В)одним и тем же веществом Г)ядовитыми веществами 4.Из за взаимного влияния атомов в карбоксильной группе А) связь О-Н ослабляется Б) атом С притягивает к себе неподеленную электронную пару атома кислорода в группе ОН В) атом Н более подвижен Г) все перечисленное 5.Консервант под кодом Е-260 это кислота А) метановая Б)этановая В) щавелевая Г) молочная

Ответы 1.Двухосновной кислотой является А) лимонная Б) яблочная В)щавелевая Г) акриловая 2.К ароматическим кислотам относится А) щавелевая Б)масляная В) фталевая Г)молочная 3.Малоновая и метандикарбоновая кислота являются А) изомерами Б)гомологами В)одним и тем же веществом Г)ядовитыми веществами 4.Из за взаимного влияния атомов в карбоксильной группе А) связь О-Н ослабляется Б) атом С притягивает к себе неподеленную электронную пару атома кислорода в группе ОН В) атом Н более подвижен Г) все перечисленное 5.Консервант под кодом Е-260 это кислота А) метановая Б)этановая В) щавелевая Г) молочная
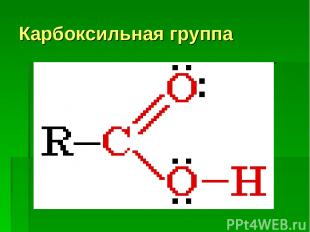
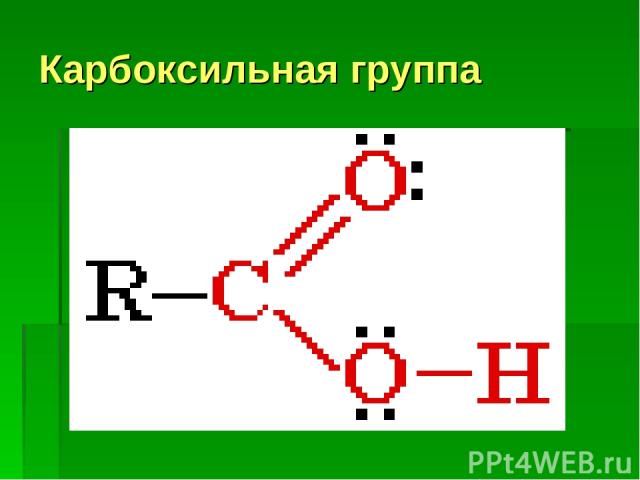
Карбоксильная группа

1 Общие кислотные свойства ссылка

А) Диссоциация карбоновых кислот: СН3–COOH ↔ СН3–COO- + H+ образующийся ион водорода придает раствору кислую среду. С какими простыми веществами реагируют кислоты? С активными металлами

Внимание, видеоопыт! ссылка

Б) Взаимодействие с металлами Запишите уравнение реакции уксусной кислоты с магнием СН3–COOH +Mg → (CH3–COO)2Mg + H2↑ Уравните 2СН3–COOH +Mg →(CH3–COO)2Mg + H2↑ ацетат магния

В) Взаимодействие с основаниями ссылка

Запишите уравнение реакции СН3–COOH + NaOH → CH3–COONa + H2О ацетат натрия

С какими солями реагировали неорганические кислоты? Кислоты реагируют с солями более слабых кислот. Из неорганических кислот какая кислота слабая? (применяем в качестве напитка) Угольная (газвода)
Внимание, видеоопыт! http://www.youtube.com/watch?v=Zu_iWhPYmqQ

Запишите уравнение реакции СН3–COOH + Na2СО3 → CH3–COONa + СО2↑ + H2О Уравните 2СН3–COOH + Na2СО3 → 2CH3–COONa + СО2↑ + H2О

2.Специфические свойства к\кислот Все данные свойства являются общими химическими свойствами для всех кислот, как органических, так и неорганических. Но карбоновые кислоты, как представители органических соединений, обладают и особыми свойствами, так называемыми – специфическими.

А)Галогенирование (замещение идет в альфа-положении). Замещение Н может протекать не только в функциональной группе, но и в радикале СН3–COOH + Cl–Cl → СН2Cl–COOH + HCl 2-хлоруксусная кислота

Б) Замещение –ОН группы. Реакция этерификации - образование сложных эфиров (при нагревании в присутствии серной кислоты). С3Н7–COOH + СН3–CH2OH ↔ С3Н7–COOСН2 СН3 + H2О Этилбутанат (фруктовый запах)

Выводы . Общие свойства, характерные для класса карбоновых кислот, обусловлены наличием в молекулах гидроксильной группы, которая содержит резко полярную связь между атомами водорода и кислорода. Для карбоновых кислот характерны свойства как общие с неорганическими кислотами, так и специфические, присущие только органическим кислотам

Самостоятельная работа 1. Какой объем газа (при н.у.) выделится при взаимодействии раствора уксусной кислоты массой 100 г (массовая доля вещества 55%), с металлическим натрием, массой 10 г? 2. Составьте уравнения химических реакции согласно цепочке превращении: Углерод → Этан → Этилен → Этанол → Этановая кислота → Ацетат магния 3. Закончите уравнения химических реакции, напишите их в молекулярном и ионном виде: а) HCOOH + Mg = б) CH3COOH + KOH = в) C2H5COOH + CaO =

Домашнее задание Устно: Изучить параграф 20 (стр 180-181 )

Использованные ресурсы и источники информации Учебник Химия 10 класс (базовый уровень). Габриелян О.С. М.: Дрофа, 2013 г. Настольная книга учителя химии 10 класс. Габриелян О.С., Остроумова И.Г. М.: «Блик и К » Органическая химия. Ким А.М. Новосибирск: Сиб. унив. изд-во, 2002 Органическая химия в тестах, задачах, упражнениях. 10 класс. О. С. Габриелян, И. Г. Остроумов, Е. Е. Остроумова. М.: Дрофа, 2003 Видеоопыты с сайта «youtube»