Презентация на тему: Классификация химических реакций

Классификация химических реакций Интегрированный урок ХИМИЯ+ИНФОРМАТИКА

Какие явления называются химическими реакциями?

По каким признакам можно определить, что у вещества изменились свойства?

А + В АВ Горения C+O2 CO2 Гидрирования (+Н2) CH2=CH2 + H2 CH3-CH3 Гидратации CH2=CH2 + H2O CH3-CH2-OH Какие реакции называются реакциями соединения ?

Пример реакции соединения

Какие реакции называются реакциями разложения? АВ А+В

АВ + СD AD + BC (Условие: Газ, осадок, вода) Примеры: Na4Cl + HNO3 = NaNO3 + H2O 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 (газ)+ 2H2O CuSO4 + 2KOH = Cu(OH)2 (осадок)+ K2SO4 Какие реакции называются реакциями обмена?

Какие реакции называются реакциями замещения? А + ВС АС + В Взаимодействие Ме с кислотами Zn + 2HCl = ZnCl2 + H2 Взаимодействие щелочных и щелочноземельных Ме с водой 2Na + 2H2O= 2NaOH + H2

Примеры реакции замещения

Какие реакции называются термохимическими?
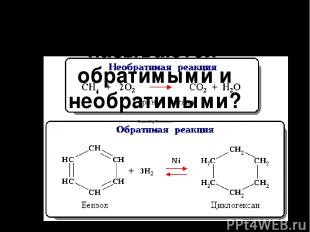
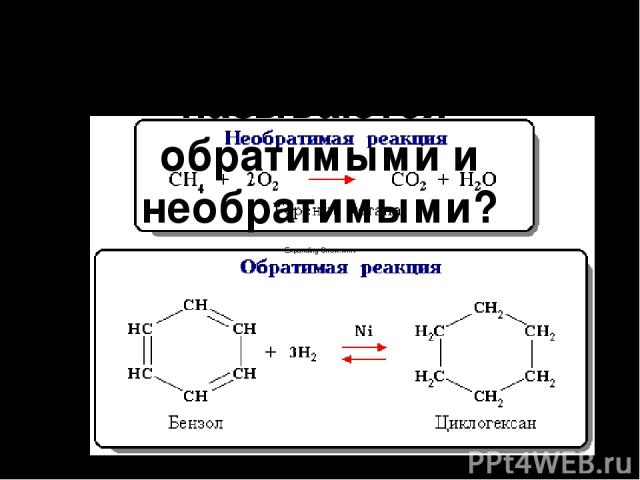
Какие реакции называются обратимыми и необратимыми?

Какие реакции называются каталитическими?

Какие реакции называются гомогенные и гетерогенные?

Самостоятельная работа Определить тип химической реакции каждого уравнения по признаку число и состав реагирующих веществ и продуктов реакции (поставить в соответствующей графе отметку) 1 вариант 2 вариант
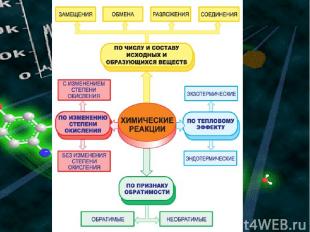
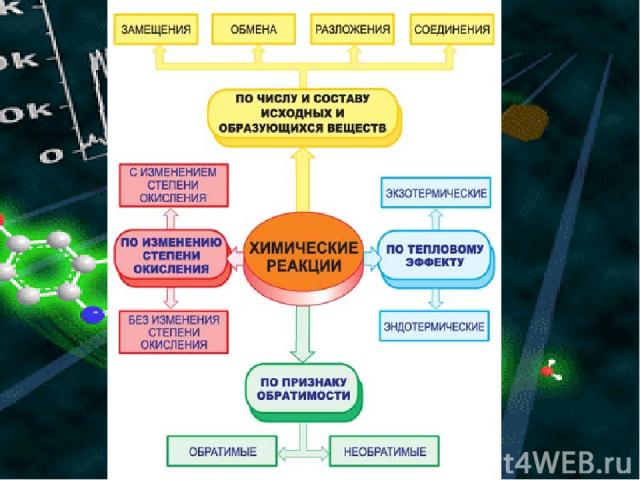
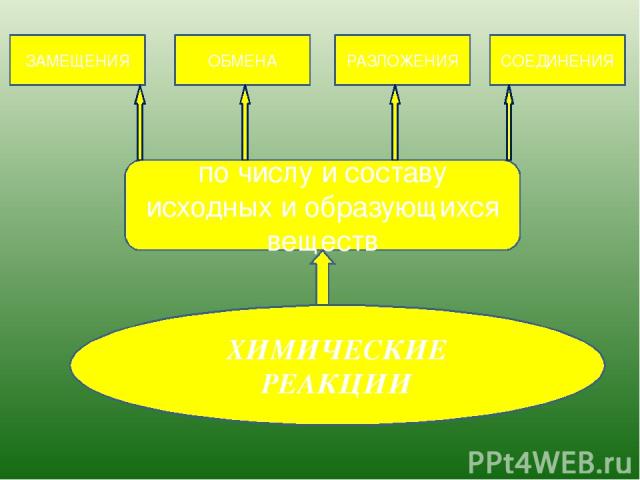
ХИМИЧЕСКИЕ РЕАКЦИИ по числу и составу исходных и образующихся веществ ЗАМЕЩЕНИЯ ОБМЕНА РАЗЛОЖЕНИЯ СОЕДИНЕНИЯ
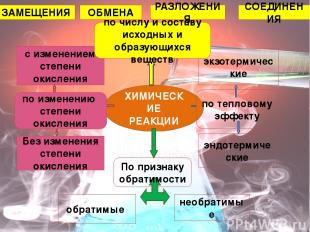
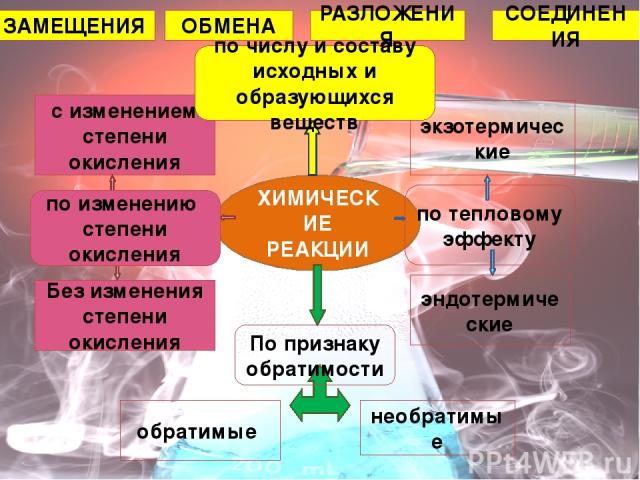
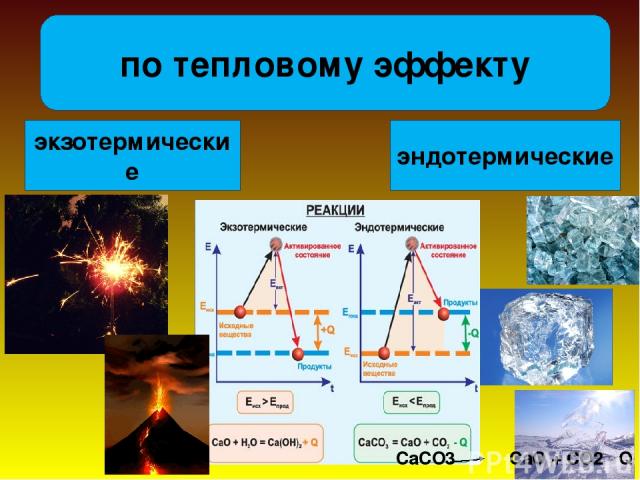
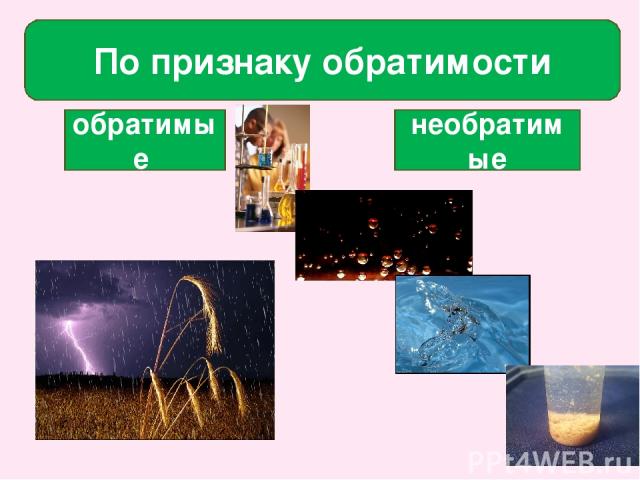
ХИМИЧЕСКИЕ РЕАКЦИИ Без изменения степени окисления с изменением степени окисления по изменению степени окисления по числу и составу исходных и образующихся веществ ЗАМЕЩЕНИЯ ОБМЕНА РАЗЛОЖЕНИЯ СОЕДИНЕНИЯ По признаку обратимости обратимые необратимые эндотермические экзотермические по тепловому эффекту

по изменению степени окисления с изменением степени окисления Без изменения степени окисления окислительно-восстановительные Mg+ H2SO4 = MgSO4 + H2 NH3 + H2O = NH4OH Приготовление аммиачной воды
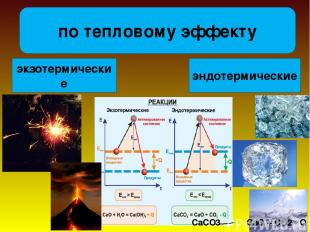
эндотермические экзотермические по тепловому эффекту CaCO3 CaO + CO2 - Q
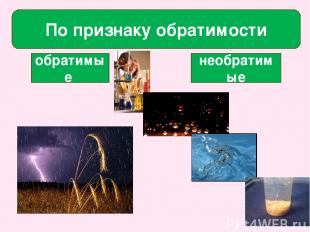
По признаку обратимости обратимые необратимые

Практическая работа в группах

Презентация - слово, имеющее два значения: обычное, в смысле: показ нового товара, предъявление широкой публике новой коллекции мод или кинофильма; то же самое для новой компьютерной программы перед началом её продаж; рекламная, популяризирующая акция; узкое, в смысле: документ, созданный в программе PowerPoint

Достоинства презентаций Последовательность изложения. При помощи слайдов, сменяющих друг друга на экране, удержать внимание аудитории гораздо легче, чем двигаясь с указкой между развешанных по всему залу плакатов. Возможность воспользоваться официальными шпаргалками. Презентация – это не только то, что видит и слышит аудитория, но и заметки для выступающего: о чём не забыть, как расставить акценты. Мультимедийные эффекты. Слайд презентации – не просто изображение. В нём могут быть элементы анимации, аудио- и видеофрагменты. Они способны не только украсить презентацию, но и существенно повысить её информативность. Копируемость. Копии электронной презентации создаются мгновенно и ничем не отличаются от оригинала. При желании каждый слушатель может получить на руки все показанные материалы. Транспортабельность. Диск или Flash-карта гораздо компактнее свёртка плакатов и уж тем более как в нашем случае- набора химикатов и приборов для проведения химических опытов, показанных вам выше. Самое важное в подготовке презентаций – это не число новых и необычных возможностей, а простота выполнения и степень автоматизированности тех операций, которые приходится выполнять чаще всего.


Задание Дайте характеристику реакции горения древесины по изученным признакам С+О2 СО2 + Q

СПАСИБО ЗА УРОК!