Презентация на тему: Электролиз (на примере электролиза расплава хлорида натрия и раствора хлорида меди (II)). Процессы, протекающие на катоде и аноде. Применение электролиза.

Презентацияпо дисциплине «Химия»по теме «Электролиз (на примере электролиза расплава хлорида натрия и раствора хлорида меди (II)). Процессы, протекающие на катоде и аноде. Применение электролиза.»студентки гр. 1ГК-5СГБОУ СПО КГИС N1Чистовой ЕленыПреподаватель: Гудкова Е.С.2010-2011гг

Электролиз – окислительно-восстановительный процесс, происходящий на электродах при пропускании постоянного электрического тока через раствор или расплав электролита.
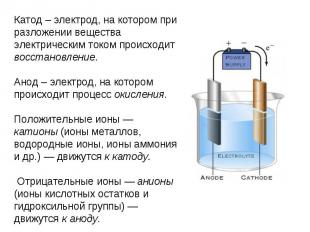
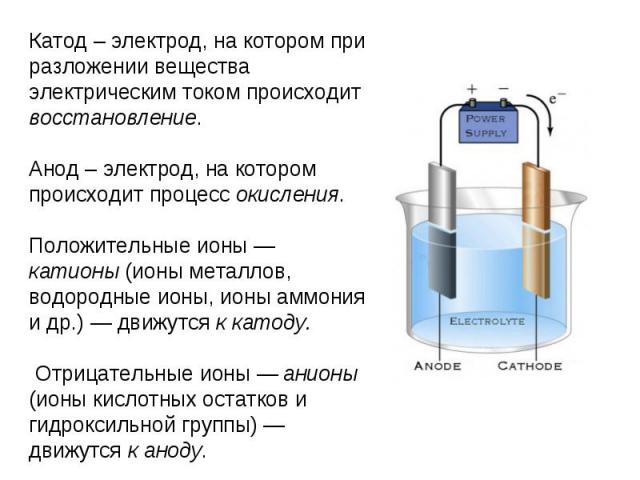
Катод – электрод, на котором при разложении вещества электрическим током происходит восстановление.Анод – электрод, на котором происходит процесс окисления.Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду. Отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
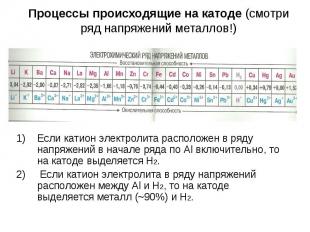
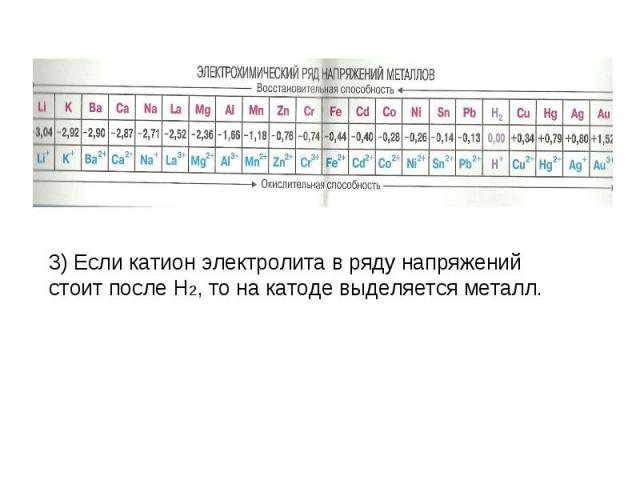
Если катион электролита расположен в ряду напряжений в начале ряда по Al включительно, то на катоде выделяется H2. Если катион электролита в ряду напряжений расположен между Al и H2, то на катоде выделяется металл (~90%) и H2.
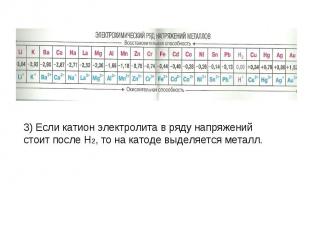
3) Если катион электролита в ряду напряжений стоит после H2, то на катоде выделяется металл.

При электролизе растворов солей безкислородных кислот (кроме HF (фторидов)) на аноде образуются простые вещества.При электролизе раствора кислородосодержащих солей и фторидов на аноде выделяется О2.
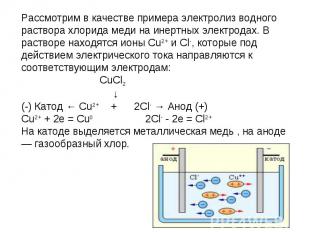
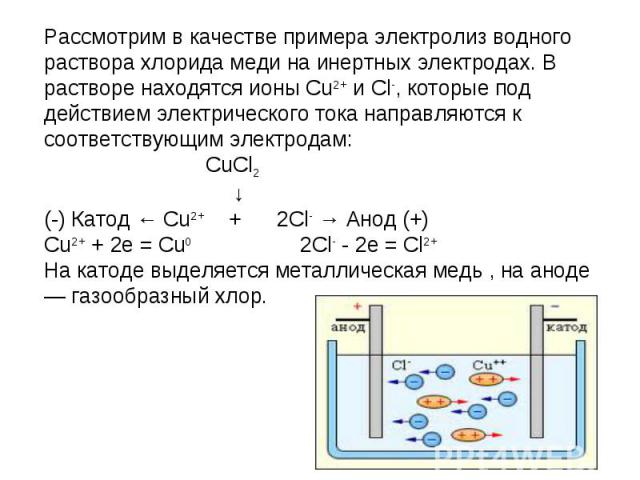
Рассмотрим в качестве примера электролиз водного раствора хлорида меди на инертных электродах. В растворе находятся ионы Cu2+ и Cl-, которые под действием электрического тока направляются к соответствующим электродам: CuCl2 ↓(-) Катод ← Cu2+ + 2Cl- → Анод (+) Cu2+ + 2e = Cu02Cl- - 2e = Cl2+На катоде выделяется металлическая медь , на аноде — газообразный хлор.
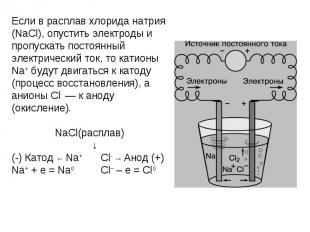
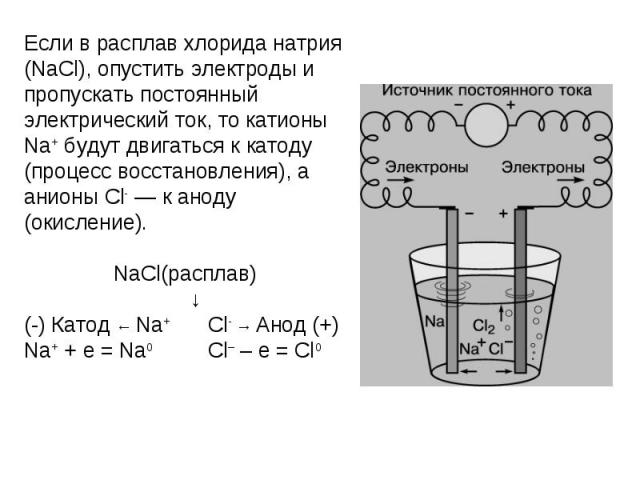
Если в расплав хлорида натрия (NaCl), опустить электроды и пропускать постоянный электрический ток, то катионы Na+ будут двигаться к катоду (процесс восстановления), а анионы Cl- — к аноду (окисление). NaCl(расплав) ↓(-) Катод ← Na+ Cl- → Анод (+)Na+ + e = Na0 Cl– – e = Cl0

Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование).

Электролизом пользуются для покрытия металлических предметов никелем, хромом, цинком, оловом, золотом и т.д.

Электролиз находит применение в очистке воды – удаление из нее растворимых примесей. В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной).

В процессе производства алюминия электролизом применяются различные виды сырья и выделяются твердые и газообразные вещества, которые оказывают негативное воздействие на окружающую природу и человека.