Презентация на тему: Степень окисления 8 класс

Степень окисления Химия 8 класс

Определите тип химической связи для веществ: NaNaClCl2HCl

У каких веществ будут наблюдаться заряды атомов в соединенияхNaNaClCl2HCl

Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов.
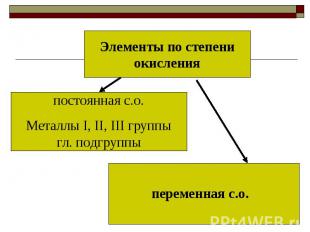
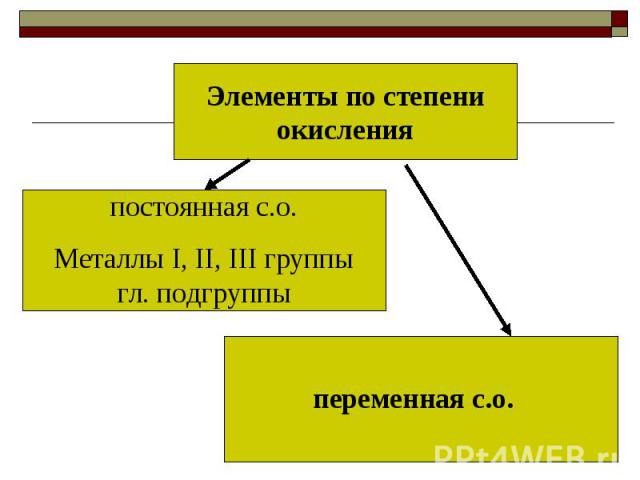
Элементы по степени окисленияпостоянная с.о.Металлы I, II, III группы гл. подгруппыпеременная с.о.

Запиши правилаУ атомов кислорода с.о. всегда -2.У атомов водорода с.о. +1, с металлами -1.У металлов в соединениях с.о. всегда «+». Значение равно номеру группы.У свободных атомов и простых веществ с.о. равна 0.У неметаллов в соединениях с.о. с металлами всегда «–» и равна значению «8-№ группы.»Суммарная с.о. атомов в соединении равна «0»
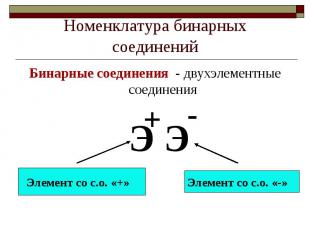
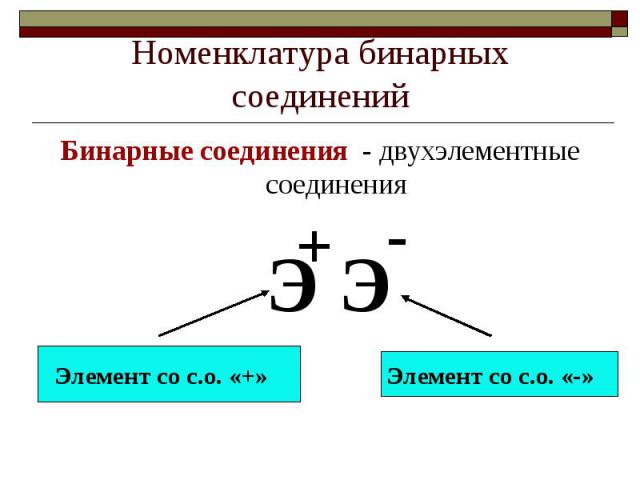
Номенклатура бинарных соединенийБинарные соединения - двухэлементные соединения

Название бинарных соедиенений– латинское с суффиксом «ид»Хлорид – соединения хлораКарбид – соединения углеродаСульфид – соединения серыОксид – соединения кислородаБромид – соединения бромаФосфид – соединения фосфора
Определение степени окисления по формуле

Выполните задание1 Определите с.о. у оксидов азота. NO N2O N2O3 NO2 N2O52 Определите с.о. и дайте названия веществам.Na2S Na3N NaBr MgCl2 MgS Mg3N2 Al2S3 Al2O3N2O NH3 SO3 SO2 H2S Fe2O3

Составление формул по с.о.1 если с.о. одинаковы, то индексы не ставят.2 если с.о. разные и их нельзя сократить, то их ставят крест накрест3 если с.о. разные и сокращаются, то их сокращают и ставят крест накрест.

Составление формул по степени окисления

Выполните задание 1 Составьте формулы по степени окисленияА) Оксидов: марганца II, IV, VI, VII.Б) Нитридов: натрия, кальция, алюминия.В) гидрида бария, хлорида фосфора, сульфида алюминия, хлорида сурьмы Sb (IV)

Домашнее заданиеПараграф 17 упр. №1,2,4,5.Р.Т. стр 54-57

Оксиды

Расставьте степени окисления и составьте формулы веществСuO PO KO FeO SOСuO P2O5 K2O Fe2O3 SO3Что общего в составе всех этих веществ?

Оксиды – сложные вещества, состоящие из двух химических элементов, один из которых кислород в с.о. -2.

Запишите формулы веществ и расставьте с.о. H2SO4 SO2 K2SO4 OF2 H2O H2O2 WO3SO2 H2O WO3 - оксидыH2SO4 K2SO4 OF2 H2O2Почему эти вещества не являются оксидами?

Оксиды в природеЗапишите формулы оксидов встречающихся в природеРуды железа Оксид железа III красный железнякОксид железа II бурый железнякОксид железа (смешанный II III) магнитный железняк

Запишите формулы оксидов встречающихся в природеОксид кремния песок, кварцОксид алюминия глина, бокситОксид водорода водаОксид углерода IV углекислый газОксид углерода II угарный газ

Запишите формулы оксидов встречающихся в природе Оксид азота IV бурый газОксид серы IV сернистый газОксид кальция II негашенная известь

Решите задачу Какой объем займут 88 г углекислого газа?Сколько атомов каждого элемента содержится в этом объеме?V(CO2) = 44,8 лN (C) = 6,02 * 10N (O) = 12,4 * 10

Домашнее задание 1 Составить рассказ о водородных соединениях встречающихся в природе.2 Составить рассказ об оксидах встречающихся в природе3 Параграф 18 упр 1, 4, 6.