Презентация на тему: Составление уравнений ОВР

Составление уравнений ОВР

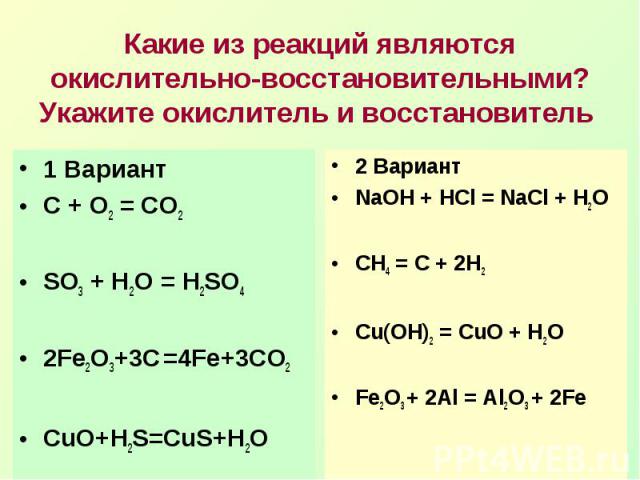
Какие из реакций являются окислительно-восстановительными? Укажите окислитель и восстановитель 1 ВариантС + О2 = СО2SO3 + H2O = H2SO42Fe2O3+3C =4Fe+3CO2CuO+H2S=CuS+H2O2 ВариантNaOH + HCl = NaCl + H2OCH4 = C + 2H2Сu(OH)2 = CuO + H2OFe2O3 + 2Al = Al2O3 + 2Fe

1 ВариантС0 + О20 = С+4О2-2C0 - 4e = C+4 - ок-ие, в-льO0 + 2e = O-2 - в-ие, ок-ль2Fe2+3O3+3C0 =4Fe0 +3C+4O2C0 - 4e = C+4- ок-ие, в-льFe+3 +3e = Fe0-в-ие, ок-ль2 ВариантC-4H4+ = C0 + 2H20C-4 – 4e = C0 - ок-ие, в-льH+ + 1e = H0 - в-ие, ок-льFe2+3O3 + 2Al0 = Al2+3O3 + 2Fe0Al0 -3e =Al+3- ок-ие, в-льFe+3 + 3e = Fe0 - в-ие, ок-ль

2Fe2+3O3+3C0 = Fe0+ C+4O2C0 - 4e = C+4- ок-ие, в-льFe+3 + 3e = Fe0- в-ие, ок-ль

6C+4 + 6 ∙ 4e = 6C0 42O-2 – 2∙2e = O224

Fe + O2 = Fe2O3Fe0 - 3e = Fe+3 - ок-ие, в-льO2 + 4e = 2O-2 - в-ие, ок-ль

Расставьте коэффициенты методом электронного балансаZn + HCl = ZnCl2 + H2Cu + HNO3 = Cu(NO3)2 + NO2 + H2O Al + O2 = Al2O3P + O2 =P2O5

Домашнее задание§ 43 Раб. тетр.: Стр. 162-163, упр. 12 упр. 13(а-в) упр. 13