Презентация на тему: Кислоты


Что такое кислоты? Слова "кислота" и "кислый" не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты можно пробовать на язык – среди них встречаются очень едкие и даже ядовитые. Но такие кислоты как уксусная (содержится в столовом уксусе), яблочная, лимонная, аскорбиновая (витамин С), щавелевая и некоторые другие (эти кислоты содержатся в растениях) знакомы вам именно своим кислым вкусом.

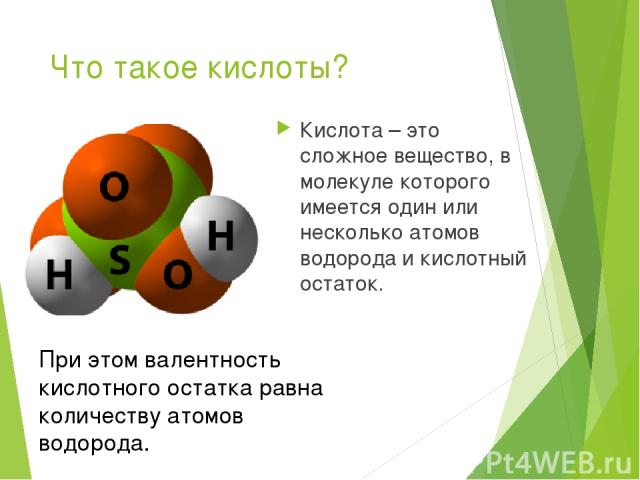
Что такое кислоты? Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток. При этом валентность кислотного остатка равна количеству атомов водорода.

Классификация кислот Классификация кислот по составу. Кислородсодержащие кислоты Бескислородные кислоты H2SO4 серная кислота H2SO3 сернистая кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота

Классификация кислот По содержанию кислорода бескислородные (HCl, H2S); кислородосодержащие (HNO3). По основности — количество кислых атомов водорода Одноосновные (HPO3); Двухосновные (H2SeO4, Азелаиновая кислота); Трёхосновные (H3PO4). Четырёхосновные (H4СO4).

Классификация кислот . По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на одноосновные (с одним атомом водорода), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н) ** Термин "одноосновная кислота" возник потому, что для нейтрализации одной молекулы такой кислоты требуется "одно основание", т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH: HNO3 + NaOH = NaNO3 + H2O HCl + KOH = KCl + H2O Двухосновная кислота требует для своей нейтрализации уже "два основания", а трехосновная – "три основания": H2SO4 + 2 NaOH = Na2SO4 + 2 H2O H3PO4 + 3 NaOH = Na3PO4 + 3 H2O Одноосновные Двухосновные Трехосновные HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая H3PO4 фосфорная

Химические свойства кислот Взаимодействие с оксидами металлов с образованием соли и воды: Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации): Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:

Химические свойства Взаимодействие с солями, если выпадает осадок или выделяется газ:

Кислоты в нашей жизни Азотная кислота широко используется для производства удобрений, красителей, лаков, пластмасс, лекарственных и взрывчатых веществ, а также химических волокон. Серная кислота расходуется в больших количествах для производства минеральных удобрений, красителей, химических волокон, пластмасс, лекарственных веществ. Используется для извлечения металлов из руд; заполнения кислотных аккумуляторов. Находит применение в нефтяной промышленности для очистки нефтепродуктов. Фосфорная кислота используется в составах для обезжиривания металлических поверхностей перед нанесением защитных покрытий, входит в состав композиций для преобразования ржавчины перед покраской, применяется для защиты от коррозии трубопроводов, прокачивающих морскую воду. Соляная кислота широко применяется в нефтяной промышленности для обработки призабойных зон скважин с целью увеличения нефтеотдачи пластов, используется в составах травильных растворов для удаления ржавчины и отложений в трубопроводах и скважинах, а также как отвердитель фенол-формальдегидных смол.

Задачи Напишите реакции нейтрализации между кислотами и основаниями, в результате которых получаются следующие соли: Al2(SO4)3, NiCO3, Fe(NO3)3, Mg3(PO4)2, PbS, Li2SO4. Сколько P2O5 необходимо для получения 392 кг фосфорной кислоты H3PO4 ?