Презентация на тему: Азот

Азот

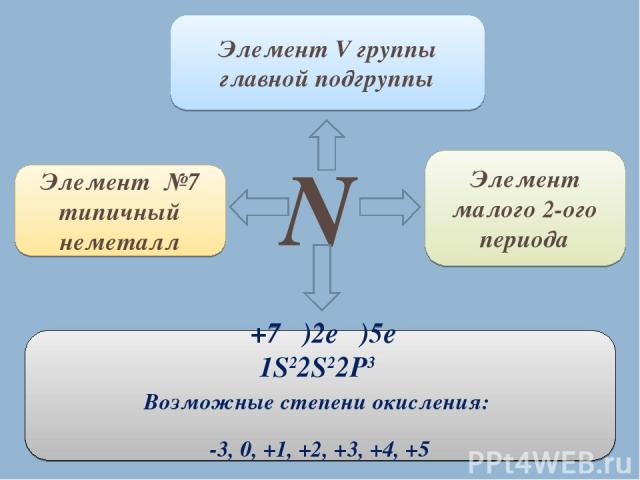
Азот (от греч. azoos - безжизненный, лат. Nitrogenium), N, химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14,0067; бесцветный газ, не имеющий запаха и вкуса.
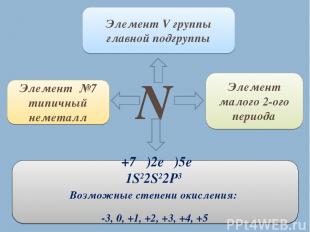
N Элемент №7 типичный неметалл Элемент V группы главной подгруппы Элемент малого 2-ого периода +7 )2e )5e 1S22S22P3 Возможные степени окисления: -3, 0, +1, +2, +3, +4, +5

Историческая справка Соединения Азота - селитра, азотная кислота, аммиак - были известны задолго до получения Азота в свободном состоянии. В 1772 году Д. Резерфорд, сжигая фосфор и других вещества в стеклянном колоколе, показал, что остающийся после сгорания газ, названный им "удушливым воздухом", не поддерживает дыхания и горения. В 1787 году А. Лавуазье установил, что "жизненный" и "удушливый" газы, входящие в состав воздуха, это простые вещества, и предложил название "Азот".

Историческая справка В 1784 году Г. Кавендиш показал, что Азот входит в состав селитры; отсюда и происходит латинское название Азот (от позднелатинского nitrum - селитра и греческого gennao - рождаю, произвожу), предложенное в 1790 году Ж. А. Шапталем. К началу 19 века были выяснены химическая инертность Азота в свободном состоянии и исключительная роль его в соединениях с других элементами в качестве связанного азота. С тех пор "связывание" Азота воздуха стало одной из важнейших технических проблем химии.

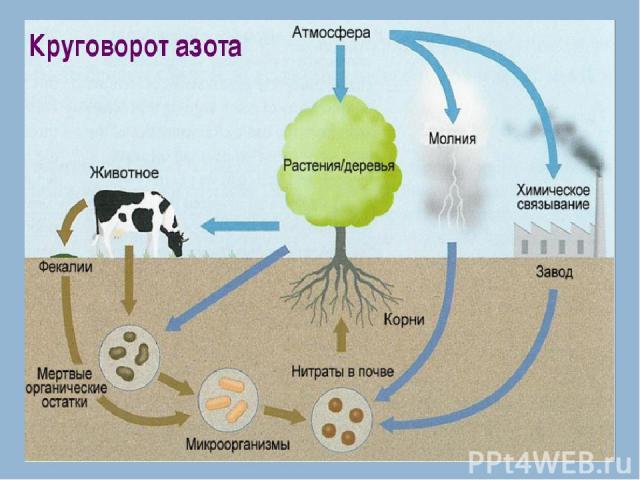
Нахождение в природе По распространенности в земной коре азот занимает 17-е место, на его долю приходится 0,0019% массы земной коры В связанном виде — в основном в составе двух селитр: натриевой NaNO3 (встречается в Чили, отсюда название чилийская селитра) и калиевой KNO3 (встречается в Индии, отсюда название индийская селитра) и ряда других соединений. В свободном виде – в атмосфере Содержание в воздухе 78% по объему

Азот присутствует во всех живых организмах (1-3% на сухую массу), являясь важнейшим биогенным элементом. Он входит в состав молекул белков, нуклеиновых кислот, коферментов, гемоглобина, хлорофилла и многих других биологически активных веществ.

Молекула двухатомарная и очень прочная Структурная формула N N
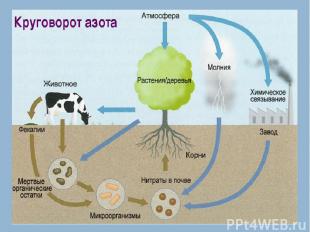

Азот — газ без цвета, запаха и вкуса. Мало растворим в воде (в 100 объемах воды растворяется 2,5 объема азота). Он легче воздуха — 1 литр азота имеет массу 1,25 г. При -196 С0 азот сжижается, а при -210 С0 превращается в снегообразную массу. N2

Азот реагирует с кислородом (при температуре электрической дуги) N2 + O2 =2NO 2. Азот реагирует с водородом (при температуре 300 0C и давлении 20-30 МПа) N2 +3H2 =2NH3 3. При повышенной температуре азот реагирует с некоторыми металлами 3Mg + N2 =Mg3N2 Химические свойства азота

Завод по производству азота из жидкого воздуха Чистый азот в промышленности наряду с кислородом и другими газами получают фракционной перегонкой жидкого воздуха. Этот процесс включает три стадии. На первой стадии из воздуха удаляют частицы пыли, пары воды и углекислый газ. Затем воздух сжижают, охлаждая его и сжимая до высоких давлений. На третьей стадии фракционной перегонкой жидкого воздуха разделяют азот, кислород и аргон. Первым отгоняется азот, затем кислород. Получение азота в промышленности: Фракционной перегонкой жидкого воздуха

Получение азота в лаборатории (разложением солей аммония) 1. Разложением нитрита аммония NH4NO2=N2 + 2H2O 2. Разложением дихромата аммония (NH4)2Cr2O7=Cr2O3+N2+4H2O

Применение Как хладагент В косметологии Для создания инертной среды при опытах Для синтеза аммиака N2
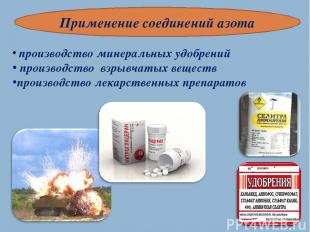
Применение соединений азота производство минеральных удобрений производство взрывчатых веществ производство лекарственных препаратов

Интересные факты об азоте

Интересные факты об азоте

Интересные факты об азоте