Презентация на тему: Атом – сложная частица

Атом – сложная частица 11 класс

Цели и задачи Познакомить учащихся с эволюцией научных взглядов на строение атома Показать взаимодействие наук физики и химии

Представления о строении атома Атом – «неделимая» частица химического элемента Доказательства сложности строения атома Открытие катодных лучей (1897г., Дж. Томсон) Открытие рентгеновских лучей (1895г., К. Рентген), явления фотоэффекта 1889 г., А.Г. Столетов) 3.Открытие радиактивности (1896 г.,А. Беккерель) и её изучение (1897-1903 гг., супруги М. Склодовская- Кюри и П. Кюри)

СЛОВО «АТОМ» ПРИДУМАЛ БОЛЕЕ 2500 ЛЕТ НАЗАД ДРЕВНЕГРЕЧЕСКИЙ ФИЛОСОФ ДЕМОКРИТ АТОМ – ЭТО МЕЛЬЧАЙШАЯ ХИМИЧЕСКИ НЕДЕЛИМАЯ ЧАСТИЦА ВЕЩЕСТВА

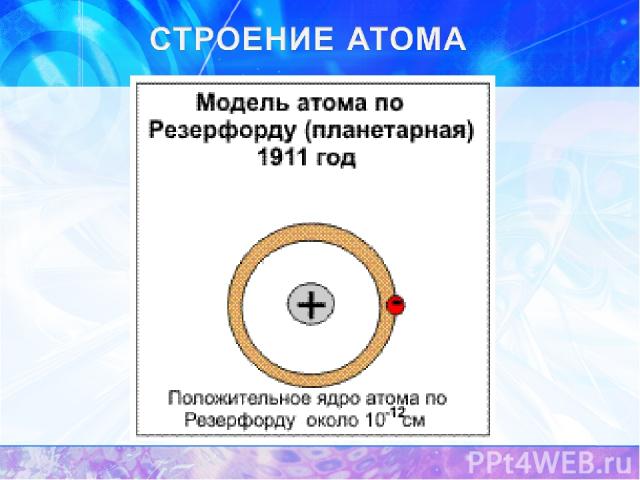
Представления о строении атома Классическая теория строения атома Модели строения атома: 1. «Пудинг с изюмом» (1902-1904 гг.,Дж. Томсон и В. Кельвин 2. Планетарная модель (1907г., Э. Резерфорд) 3. Модель Бора (1913) Современные представления о строении атома на основе квантовой механики

МОДЕЛЬ АТОМА ТОМСОНА Атом, по мысли Дж. Томсона, очень похож на пудинг с изюмом: электроны, как "изюминки", а "каша" - положительно заряженное вещество атома . Джозеф Джон ТОМСОН


Постулаты Н. Бора электроны в атоме вращаются по строго определённым замкнутым орбитам, не испуская и не поглощая энергии; при переходе электронов с одной орбиты на другую происходит поглощение или выделение энергии.

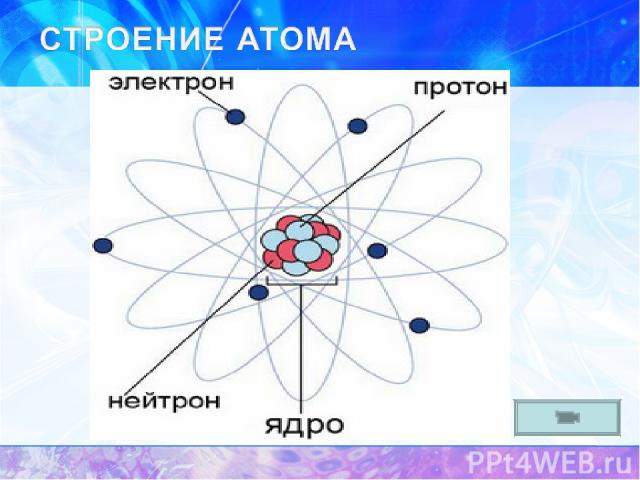
Современная квантовая модель Н. Бор - создатель первой квантовой теории атома и активный участник разработки основ квантовой механики. Также он внёс значительный вклад в развитие теории атомного ядра и ядерных реакций, процессов взаимодействия элементарных частиц со средой. Электрон имеет двойственную (корпускулярно-волновую природу) -28 -19 Масса = 9,1*10 г ; заряд =1,6*10 Кл Движущийся электрон обладает свойствами волны (способность к дифракции интерференции)
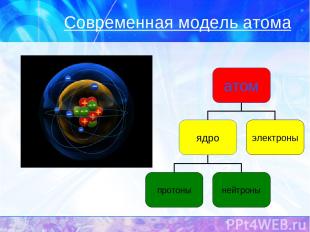
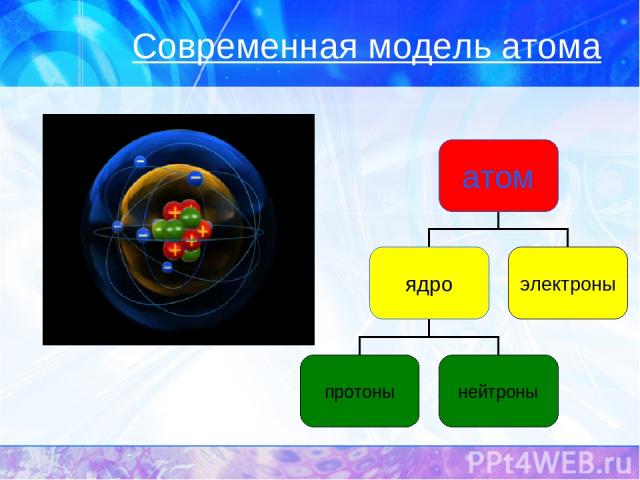
Современная модель атома
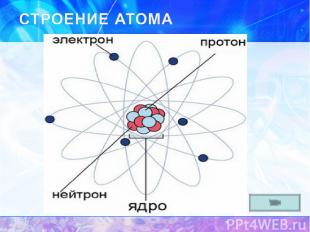


Z – порядковый номер химического элемента A – массовое число, A=Ar N – число нейтронов

Число p Z p = Z (порядковому номеру химического элемента) Число ē Z ē = Z (порядковому номеру химического элемента) Число n N = A – Z (массовое число минус порядковый номер химического элемента) + + о
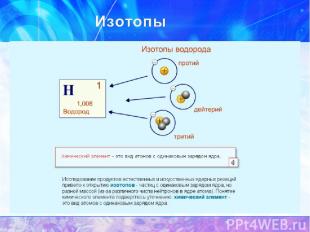

Нуклиды - различные виды атомов. Нуклиды характеризуются массовым числом А и зарядом ядра Z. Изотопы - нуклиды с одинаковыми Z, но разными А Изобары – нуклиды с разными Z, но одинаковыми А

Задание 1. Запишите для 2-3 элементов (по вашему выбору). Элемент Порядковый номер Относительная атомная масса Заряд ядра атома Число протонов Число нейтронов Число электронов

Задание 2. Выполните следующие упражнения Назовите элемент, содержащий 23 протона. Назовите элементы II периода, содержащие 8 нейтронов и запишите их. Назовите и запишите символы элементов, в которых сумма протонов и нейтронов равна 40. В ядре атома химического элемента А содержится 11 протонов и 12 нейтронов, а в ядре атома химического элемента В – 12 протонов и 12 нейтронов. Определите, являются ли они: а) изотопами одного элемента; б) атомами двух химических элементов, у которых одинаковое массовое число; в) атомами двух разных элементов, находящихся в периодической системе рядом.

Задание 3. Определить состав изотопов 35Cl и 37Cl 28Si , 29Si, 30Si 39Ar, 40Ar

«Строение атома», презентация автор Беземская И.В. учитель химии МОУ «СОШ №2 п.Сенной Вольского района Саратовской области» http://ru.wikipedia.org/wiki/ http://www.chem.msu.su/rus/teaching/