Презентация на тему: Качественные реакции катионов V и VI аналитической группы

Лабораторная работа № 5 и 6 Качественные реакции катионов V и VI аналитической группы Выполнили: Короткова К. Гарькавая А. Зинченко В. Группа 29фм4(1) 2015 г.

Качественные реакции катионов V и VI аналитической группы Катионы V аналитической группы Действие раствора 2М NaOH Действие раствора K3[Fe(CN)6] Действие раствора K4[Fe(CN)6] Действие раствора NH4NCS Иодид калия окисляется солями железа в кислой среде до свободного йода Пероксид водорода Моно гидрофосфат натрия Катионы VI аналитической группы Действие раствора аммиака Действие щёлочи Реакция на катион меди(II)
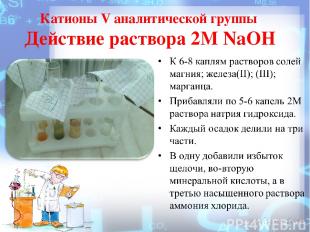
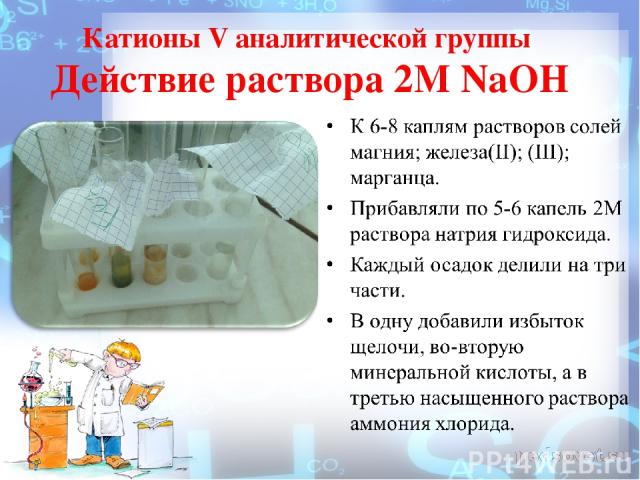
Катионы V аналитической группы Действие раствора 2М NaOH

Действие раствора 2М NaOH Наблюдали образование осадков гидроксидов катионов пятой аналитической группы: железа (II) – белый, постепенно переходящий в зеленый и бурый; железа (III) – бурый; марганца – белый, постепенно переходящий в бурый; магния - белые осадки. FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4 Fe2+ + 2OH- = Fe(OH)2↓ MnSO4 + 2NaOH = Mn(OH)2↓+ Na2SO4 Mn2+ + 2OH = Mn(OH)2↓ (белый) 2Mn(OH)2 + O2 + 2H2O →2MnO(OH)2↓ (бурый) MgSO4 + 2NaOH = Mg(OH)2↓ + Na2SO4 Mg2+ + 2OH = Mg(OH)2↓

Действие раствора 2М NaOH
![Действие раствора K3[Fe(CN)6] Действие раствора K3[Fe(CN)6]](https://fs3.ppt4web.ru/images/159218/206769/310/img5.jpg)
Действие раствора K3[Fe(CN)6]
![Действие раствора K3[Fe(CN)6] Действие раствора K3[Fe(CN)6]](https://fs3.ppt4web.ru/images/159218/206769/310/img6.jpg)
Действие раствора K3[Fe(CN)6]
![Действие раствора K4[Fe(CN)6] Действие раствора K4[Fe(CN)6]](https://fs3.ppt4web.ru/images/159218/206769/310/img7.jpg)
Действие раствора K4[Fe(CN)6]

Действие раствора NH4NCS FeCl3+NH4SCN=Fe(SCN)3+3NH4Cl
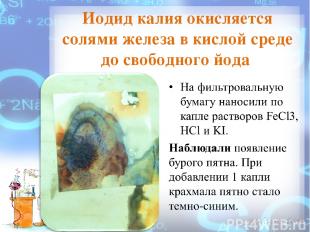
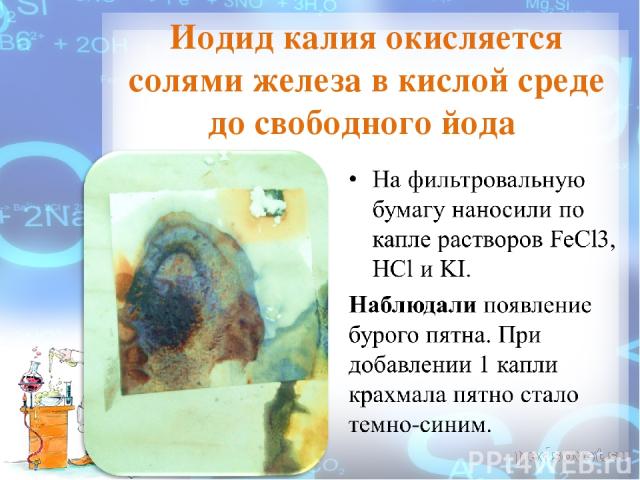
Иодид калия окисляется солями железа в кислой среде до свободного йода

Пероксид водорода

Моно гидрофосфат натрия На предметное стекло помещали по капле соли магния, аммиака и хлорида аммония. Смешивали. Помещали 1 каплю гидрофосфата натрия. Потирали по стеклу. Кристаллы рассматривали под микроскопом. MgSO4 + Na2HPO4 + 2NH4OH+NH4Cl=MgNH4PO4¯ + Na2SO4 + H2O Mg+2 + HPO4 2- + NH4OH = MgNH4PO4¯ + H2O Осадок растворяется в кислотах.
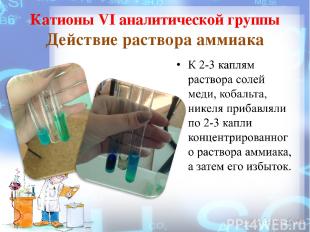
Катионы VI аналитической группы Действие раствора аммиака

Действие раствора аммиака 2Cu2+ + 2NH3 *H2 O + SO4 2- ↔ (CuOH)2SO4 ↓ + 2NH4 + 2Ni2+ + 2NH3 *H2 O + SO4 2- ↔ (NiOH)2SO4 ↓ + 2NH4 + Co2+ + NH3 *H2 O + Cl - ↔ Co(OH)Cl ↓ + NH4 + Действие избытка аммиака Co(OH)Cl ↓ + 6NH3 *H2 O → [Co(NH3 )6 ]2++ Cl- + OH- + 6H2 O (NiOH)2 SO4 ↓ + 12NH3 *H2 O → 2[Ni(NH3)6 ]2+ + SO4 2- + 2OH- + 12H2 O (CuOH)2 SO4 ↓+8NH3 *H2 O→2[Cu(NH3 )4]2+ +SO4 2- +2OH- +8H2 O Зеленый осадок Зеленый осадок Синий осадок Оранж.-коричн. р - р. Сиреневый раствор Синий раствор

Действие щёлочи К 2-3 каплям раствора солей меди, кобальта, никеля прибавляли по 2-3 капли раствора натрия гидроксида. Добавили натрия гидроксидя и хлороводородной кислоты. Наблюдали кобальт образует синий осадок. CoCl2 + NaOH− → CoOHCl↓ + NaCl−

Действие щёлочи CuCl2 + NaOH = СuОНСl + NaCl NiCl2 + NaOH = Ni(OH)2 + NaCl => NiCl2 + 2 NaOH = Ni(OH)2 + 2 NaCl CuSO4 + 2HCL= CuCL2 + H2SO4 CoSO4+2HCl => CoCl2 + H2SO4 NiCO3 + HCl = NiCl2 + CO2 + H2O => NiCO3 + 2 HCl = NiCl2 + CO2 + H2O

Действие щёлочи

Реакция на катион меди(II)

СПАСИБО ЗА ВНИМАНИЕ!!!


![Качественные реакции катионов V и VI аналитической группы Катионы V аналитической группы Действие раствора 2М NaOH Действие раствора K3[Fe(CN)6] Действие раствора K4[Fe(CN)6] Действие раствора NH4NCS Иодид калия окисляется солями железа в кислой сре… Качественные реакции катионов V и VI аналитической группы Катионы V аналитической группы Действие раствора 2М NaOH Действие раствора K3[Fe(CN)6] Действие раствора K4[Fe(CN)6] Действие раствора NH4NCS Иодид калия окисляется солями железа в кислой сре…](https://fs3.ppt4web.ru/images/159218/206769/640/img1.jpg)


![Действие раствора K3[Fe(CN)6] Действие раствора K3[Fe(CN)6]](https://fs3.ppt4web.ru/images/159218/206769/640/img5.jpg)
![Действие раствора K3[Fe(CN)6] Действие раствора K3[Fe(CN)6]](https://fs3.ppt4web.ru/images/159218/206769/640/img6.jpg)
![Действие раствора K4[Fe(CN)6] Действие раствора K4[Fe(CN)6]](https://fs3.ppt4web.ru/images/159218/206769/640/img7.jpg)




![Действие раствора аммиака 2Cu2+ + 2NH3 *H2 O + SO4 2- ↔ (CuOH)2SO4 ↓ + 2NH4 + 2Ni2+ + 2NH3 *H2 O + SO4 2- ↔ (NiOH)2SO4 ↓ + 2NH4 + Co2+ + NH3 *H2 O + Cl - ↔ Co(OH)Cl ↓ + NH4 + Действие избытка аммиака Co(OH)Cl ↓ + 6NH3 *H2 O → [Co(NH3 )6 ]2++ Cl- + O… Действие раствора аммиака 2Cu2+ + 2NH3 *H2 O + SO4 2- ↔ (CuOH)2SO4 ↓ + 2NH4 + 2Ni2+ + 2NH3 *H2 O + SO4 2- ↔ (NiOH)2SO4 ↓ + 2NH4 + Co2+ + NH3 *H2 O + Cl - ↔ Co(OH)Cl ↓ + NH4 + Действие избытка аммиака Co(OH)Cl ↓ + 6NH3 *H2 O → [Co(NH3 )6 ]2++ Cl- + O…](https://fs3.ppt4web.ru/images/159218/206769/640/img13.jpg)
















