Презентация на тему: Его Величество Железо

ЕГО ВЕЛИЧЕСТВО ЖЕЛЕЗО

ЦЕЛИ: Ознакомиться с особенностями металлургического комплекса России Изучить химические и физические свойства простого вещества - железа, ознакомиться с природными соединениями железа; Рассмотреть биологическую роль железа для живых организмов.

Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры и промышленности, оно – орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлым, настоящим и будущими судьбами человечества.А. Е. Ферсман.

Основными железными рудами являются:– магнетит Fe3O4 – содержит 72% железа, месторождения магнетита встречаются на Южном Урале, Курской магнитной аномалии;– гематит (красный железняк)Fe2O3 – содержит до 65% железа, такие месторождения - железа встречаются в Криворожском районе; – лимонит (бурый железняк)Fe2O3•nH2O – содержит до 60% железа, месторождения лимонита встречаются в Крыму, например керченское месторождение;– пирит FeS2 – содержит примерно 47% железа, месторождения пирита встречаются на Урале.

Задание: по карте атласа “Металлургия России” определите крупнейшие месторождения железной руды в России. Субъект ФедерацииМесторождениеМурманская область Оленегорское, КовдорскоеРеспублики Карелия КостомукшскоеСвердловская область Качканарское Челябинская область Бакальское, Магнитогорское Кемеровская область Горная Шория Курская область Курская магнитная аномалия Белгородская область Лебединское Красноярский край Ирбинское Иркутская область Коршуновское

Технологический цикл производства железа 1. Добыча руды (железный колчедан, магнитный железняк, где полезным компонентом является оксид Fe)2. Обогащение руды3. Агломерация руд4. Доменный цех >>> чугун5. Сталеплавильный цех>>>сталь6. Прокатный цех>>> прокат

Основные стадии технологического цикла

Добыча углядобыча железной руды


Доменный цех

Сталеплавильный цех

Прокатный цех

Изделия из чугуна


Изделия из стали

Работа с учебником: Какие типы предприятий черной металлургии существуют?


Бездоменная металлургия Производство железа методом прямого восстановления в электропечах.Руда – сталь (Старый Оскол)Первое в России предприятие этого типа было построено у подмосковного полустанка Затишье в 1917 году, ныне город Электросталь.
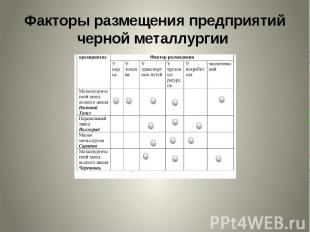
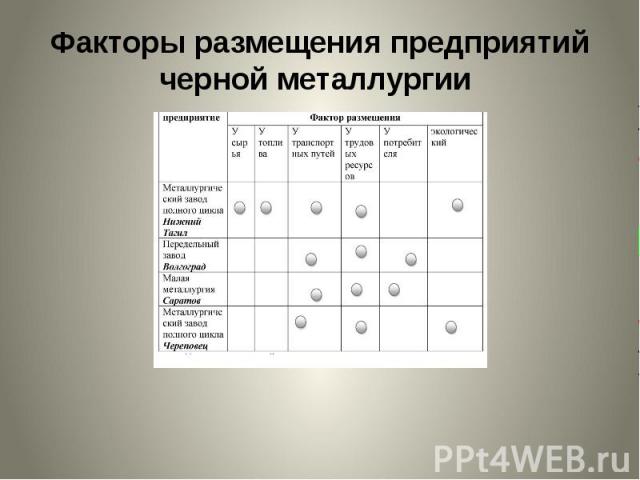
Факторы размещения предприятий черной металлургии

Сильное загрязнение окружающей среды

Положение железа в Периодической системе химических элементов Д. И. Менделеева Задание: прочитайте текст учебника и охарактеризуйте положение химического элемента железа в ПСХЭ Д. И. Менделеева и особенности строения атома данного элемента

Вывод: Железо – элемент побочной подгруппы VIII группы 4-го большого периода. Железо относится к d-элементам, электронная формула атома имеет окончание …3d64s2. Железо в соединениях проявляет степени окисления +2 и +3. Максимальная степень окисления железа +6. Она проявляется в ферратах – солях несуществующей железной кислоты. Например, Na2FeО4 – феррат натрия.

Физические свойства железа Прочитайте в учебнике физические свойства железа.

Химические свойства железа 1. Взаимодействие с неметалламиFe + S = FeS (t>700)Fe + 2S = FeS2 (t

Взаимодействие с водой 3Fe+4H2O=Fe3O4+4H2 (t>700)

Взаимодействие с кислотами Fe + 2HCl = FeCl2 + H2.Fe+H2SO4(разб)=FeSO4+H2Fe+H2SO4(ср.конц.)=FeSO4+SO2 +2H2OFe+4HNO3(разб) =Fe(NO3)2 + 2NO2 + 2H2O

В концентрированных азотной и серной кислотах железо не растворяется, так как на поверхности металла возникает пленка, препятствующая реакции металла с кислотой, поэтому концентрированные серную и азотную кислоты можно перевозить в железной таре (происходит пассивация металла).

Взаимодействие с солями Вытесняет металлы, стоящие левее в ряду напряженийFe+CuSO4=CuSO4

Домашние задания: По географии: повторить пройденный материал, в контурных картах отметить месторождения железных руд.По химии: с. 76-78 читать, запомнить химические свойства железа