Презентация на тему: Азотная кислота по химии

МОУ «СОШ № 102» Урок в 9 «Б» классе Презентацию подготовила: учитель химии Зубкова Е. А. 5klass.net

Тема: «Азотная кислота» Цель урока: Рассмотреть свойства азотной кислоты и области ее применения

План урока: 1. Проверка Д/З (письменная работа); 2. Изучение нового материала; 3. Закрепление; 4. Подведение итогов; 5. Домашнее задание, его инструктаж.

Пора проверить знания!!!

Проверка результатов Задание № 1 Запишите формулу соединения азота и его название на основании физических свойств I вариант: Бесцветный газ, плохо растворим в воде, легко соединяется с кислородом воздуха, образуя бурый газ. NO – оксид азота (II) II вариант: Бесцветный газ с характерным резким запахом, хорошо растворим в воде, легче воздуха. NH3 - аммиак

Задание № 2 Расположите соединения азота в порядке возрастания степеней окисления. I Вариант: N2, NH3, KNO3, NO, HNO2. -3 0 +2 +3 +5 NH3, N2, NO, HNO2, KNO3. II Вариант: NO2, N2O, HNO3, NH4Cl, N2O3 -3 +1 +3 +4 +5 NH4Cl, N2O, N2O3, NO2, HNO3.

Задание № 3 Составьте уравнения реакций по схеме. Назовите вещество Х. I вариант: N2 → X → NH4Cl X – NH3 (аммиак) 1. N2 + 3H2=2NH3 2. NH3 + HCl = NH4Cl II Вариант: NO2 → X → NH4NO3 X – HNO3 (азотная кислота) 1.4NO2+2H2O+O2=4HNO3 2. HNO3 + NH3=NH4NO3


Азотная кислота HNO3 I. Физические свойства азотной кислоты; II. Характеристика кислоты; III. Химические свойства ; IV. Применение азотной кислоты.

I. Физические свойства азотной кислоты Агрегатное состояние – жидкость; Цвет – отсутствует; Запах – едкий, кислотный; Растворимость в воде – хорошая; «Дымит» на воздухе; «Особые приметы»: при хранении на свету разлагается, приобретая желтоватый оттенок: 4HNO3=4NO2↑ + O2↑ + 2H2O

II. Характеристика HNO3 По основности: одноосновная 2. По содержанию «О»: кислородсодержащая 3. По растворимости в воде: растворимая 4. По стабильности: нестабильная 5. По летучести: летучая 6. По степени диссоциации: сильная

III. Химические свойства HNO3 Свойства HNO3 как электролита Диссоциация: HNO3 = H+ + NO3 - Взаимодействует А) с оксидами металлов: CuO + 2HNO3 = Cu(NO3)2 + H2O CuO + 2H+ = Cu2+ + H2O Б) с основаниями: Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O Cu(OH)2 + 2H+ = Cu2+ + 2H2O В) с солями: Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O CO32- + 2H+ = CO2 + H2O
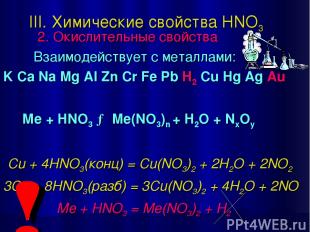
III. Химические свойства HNO3 2. Окислительные свойства Взаимодействует с металлами: K Ca Na Mg Al Zn Cr Fe Pb H2 Cu Hg Ag Au Ме + HNO3 → Me(NO3)n + H2O + NxOy Cu + 4HNO3(конц) = Cu(NO3)2 + 2H2O + 2NO2↑ 3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 4H2O + 2NO↑ Me + HNO3 = Me(NO3)2 + H2↑
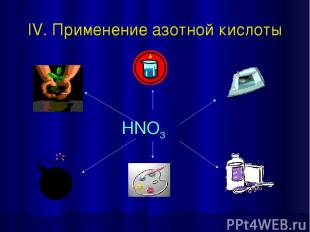
IV. Применение азотной кислоты HNO3

Вопросы на закрепление I. Характерные свойства чистой HNO3: Твердое агрегатное состояние; Хорошая растворимость в воде; Отсутствие запаха; Желтый цвет; Разлагается на свету с выделением азота; «Дымит» на воздухе.

Вопросы на закрепление II. Назовите вещества, с которыми может реагировать азотная кислота как электролит: SO2 H2 ZnO Ca(OH)2 HCl Na2SiO3 Ag III. Азотную кислоту применяют для определения примесей в золотых изделиях. Объясните, чем в ряде случаев обуславливается появление бурого газа и голубого раствора при обработке золота кислотой?

ПОРА ПОДВЕСТИ ИТОГ! Что я узнал о свойствах азотной кислоты? Где применяется азотная кислота?

Домашнее задание: Выучить § 27; Проанализировать записи в тетради; Выполнить задания № 3 – 9 стр. 109 (тетрадь с печатной основой).

Благодарим всех за внимание!