Презентация на тему: Атом в Химии

Атом в Химии
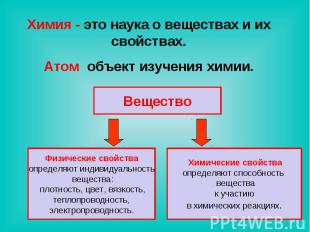
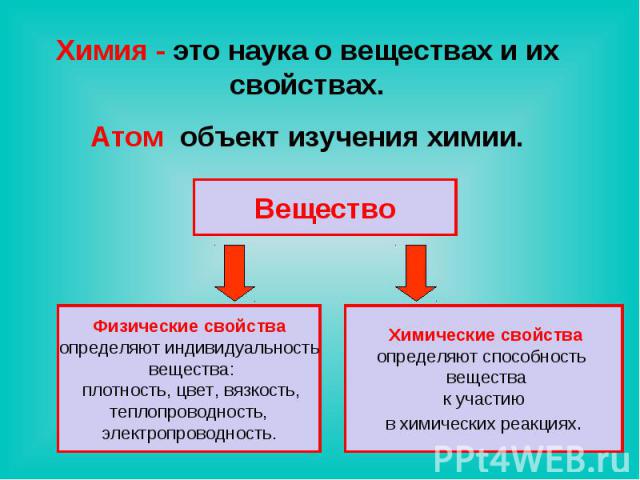
Химия - это наука о веществах и их свойствах.Атом объект изучения химии. Вещество Физические свойстваопределяют индивидуальность вещества: плотность, цвет, вязкость, теплопроводность, электропроводность. Химические свойстваопределяют способность вещества к участию в химических реакциях.

Молекула это мельчайшая частица вещества, определяющая его свойства. Молекулы бывают простые и сложные, одноатомные и многоатомные. Состав молекулы определяется молекулярной формулой. Молекулы состоят из атомов.

Атом Это наименьшая химическая частица вещества. Атом стабилен и электрически нейтрален. Определенный вид атомов называется химическим элементом. Каждый элемент имеет свое название и символ.

Периодический закон В 1869 году русским ученым ДИ Менделеевым был открыт основной закон химии, который был назван периодическим. В то время атом считался неделимым, и о его внутреннем строении ничего не было известно. Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, ученый получил естественный ряд химических элементов, в котором обнаружил периодическую повторяемость химических свойств.

Периодическая система химических элементов На основе Периодического закона Менделеев создал Периодическую систему химических элементов, состоящую из 7 периодов и 8 групп.

Атом-сложная частица В конце 19 – начале 20 веков физики доказали, что атом является сложной частицей и состоит из более простых (элементарных) частиц. В результате проведенных исследований было установлено: 1. в атоме каждого элемента (кроме водорода) присутствуют частицы трех сортов: электроны, протоны и нейтроны. 2. протоны и нейтроны сосредоточены в ядре атома, а электроны на его периферии (в электронной оболочке). 3. число протонов в ядре равно числу электронов в оболочке атома и отвечает порядковому номеру этого элемента в Периодической системе. 4. количество нейтронов в ядре может быть различным и определяется по формуле

Электронная оболочка атома представляет собой сложную систему, она делится на подоболочки с разной энергией (энергетические уровни), их количество определяется периодом в котором находится элемент в таблице; уровни подразделяются на подуровни, а подуровни включают атомные орбитали, которые могут различаться формой и размерами (обозначаются буквами s, p,d, f и др)

Вывод: Периодическое изменение свойств элементов объясняется характером изменения электронных конфигураций атомов. При взаимодействии атомов и объединении их в молекулы они обмениваются валентными электронами. Атом, отдавший электрон становится положительным ионом, а атом, принявший электрон – отрицательным ионом. Процессы, происходящие внутри атома описываются законами квантовой механики.