Презентация на тему: Атом

Атом

Периодический закон Д .И Менделеева и его высказанные на его основе гипотезы явились стимулом к выяснению строение атома.

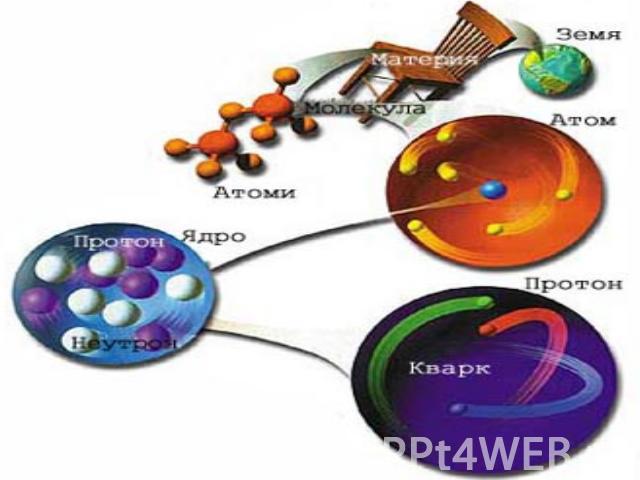
Атом (др.-греч. ἄτομος — неделимый) 1. Атом – микрочастица, имеющая форму шара. 2. Атом состоит из ядра и электронов. 3. Ядро имеет очень маленький размер (r (атома) / r (ядра) = 100000). 4. Ядро имеет положительный заряд. 5. Атом – электронейтрален, так как число протонов и электронов одинаково. 6. Электроны обладают отрицательным зарядом и движутся вокруг ядра.

Структура атома

В 1911 г. английский ученый Э. Резерфорд доказал ,что в центре атома имеется положительно заряженное ядро.

Планетарная модель строения атома Резерфорд предположил, что атом устроен подобно планетарной системе. Суть модели строения атома по Резерфорду заключается в следующем: в центре атома находится положительно заряженное ядро, в котором сосредоточена вся масса, вокруг ядра по круговым орбитам на больших расстояниях вращаются электроны (как планеты вокруг Солнца). Заряд ядра совпадает с номером химического элемента в таблице Менделеева.

На основании опытов Резерфорда было установлено: Атом Ядро Электронная оболочка Состоит из нуклонов Состоит из электронов (ē) Протон Нейтрон P+ n0 «Нуклеус» (латинское nucleus) – ядро. Масса атома сосредоточена в ядре. Поэтому эта модель называется - нуклеарная.
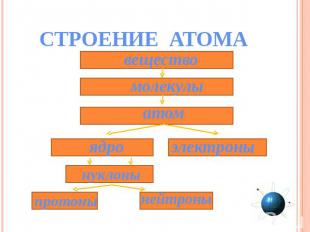
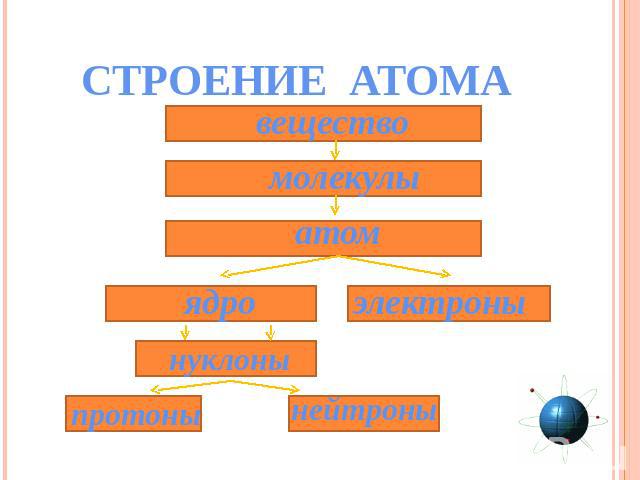
СТРОЕНИЕ АТОМА вещество молекулы атом ядро электроны нуклоны протоны нейтроны

Строение атома на примере О +8О ( 1)Число протонов и электронов равны порядковому номеру элемента 2)Что бы найти число нейтронов, нужно из молекулярной массы элемента вычесть массу протонов или электронов.

У кислорода порядковый номер равен 8 ,поэтому число электронов и протонов равны 8,а молекулярная масса кислорода равна 16, поэтому чтобы найти число нейтронов надо из 16 (молекулярной массы кислорода) вычесть заряд ядра (или число протонов или число элетронов)

5 формул строения атома 1)Определение числа протонов, электронов и нейтронов у елемента 2)Распределение электронов по энергетическим уровням 3)Электронная формула элемента 4)Ячеечное строения элемента 5)Графическое изображение электронов, находящихся на внешнем энергетическом уровне
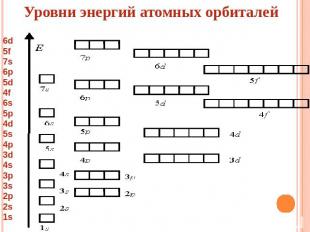
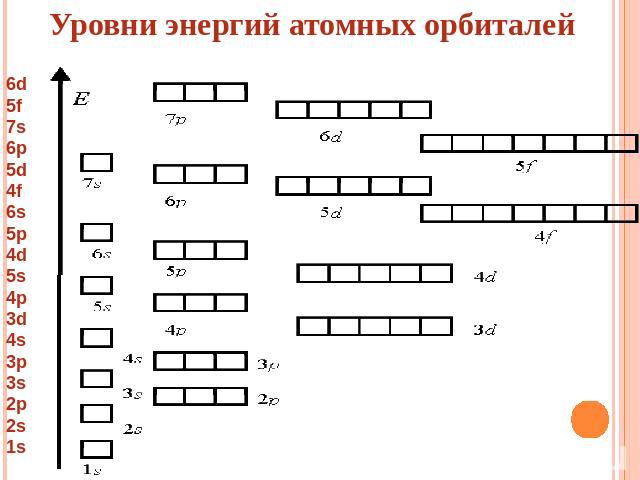
Уровни энергий атомных орбиталей