Презентация на тему: Аммиак

Каково строение атома азота? Каковы химические свойства азота? В чем причина противоречия между высокой реакционной способностью элемента азота и инертностью молекулярного азота? Какова история открытия азота? 5klass.net

Проблемно- исследовательский урок химии в 9-м классе Аммиак

План урока. 1. Актуализация знаний. 2. Значение связывания азота. 3. Строение молекулы аммиака. 4. Получение. 5. Физические свойства. 6. Биологическое действие. 7. Аммиак в природе. 8. Химические свойства. 9. Применение. 10.Закрепление знаний.
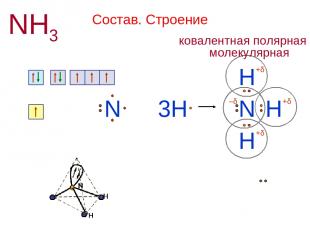
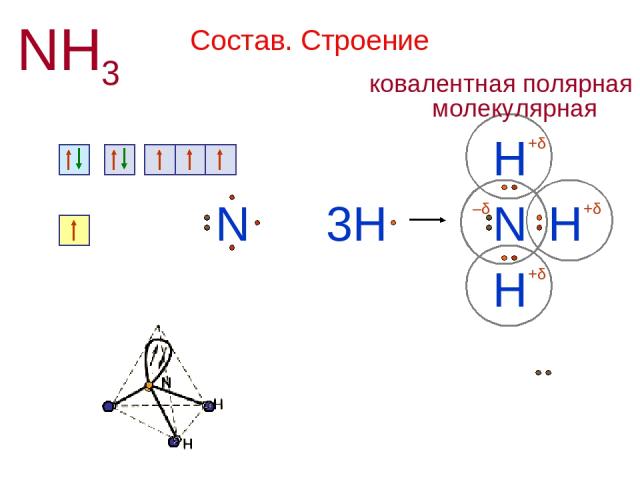
Состав. Строение NH3 N 1s2 2s2 2p3 + H N H H 3H H N 1s1 +δ +δ +δ –δ Н или H H H N — — │ 107,3º Химическая связь ковалентная полярная Кристаллическая решетка молекулярная
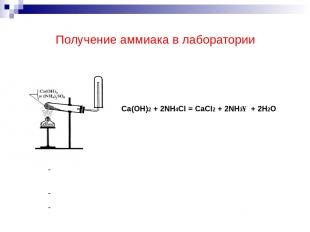
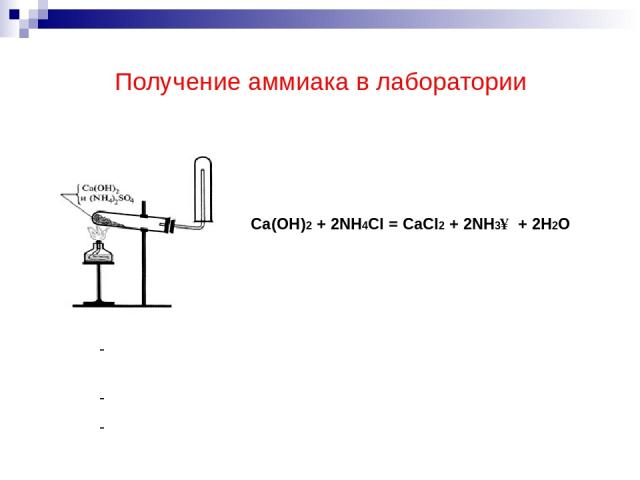
Получение аммиака в лаборатории Ca(OH)2 + 2NH4Cl = CaCl2 + 2NH3↑ + 2H2O Поднесите влажную фенолфталеиновую и красную лакмусовую бумажку. Что вы наблюдаете? Какую среду имеет раствор аммиака?

Физические свойства При незначительном повышении давления или при охлаждении до – 33Сº аммиак сжижается, превращаясь в бесцветную подвижную жидкость. Аммиак растворим в воде: при комнатной температуре в 1объеме воды растворяется 700 объемов аммиака, а при 0ºС – 1200 объемов.

Биологическое действие аммиака. + Средства I помощи при отравлении аммиаком: - Свежий воздух, Обильное промывание глаз водой, Вдыхание водяного пара.

Химические свойства Является восстановителем. За счет чего аммиак может вступать в реакции присоединения?

Применение аммиака 1. Производство пластмасс и волокон 2. В составе моющих средств 4. В сельском хозяйстве 4. В медицине 6. Получение взрывчатых веществ 5. Производство азотной кислоты 3. Производство азотных удобрений

NH3 1 4 2 3 5 6 7

ПДК аммиака составляет 0,001 мг/л. Рассчитайте концентрацию аммиака после проведения лабораторного опыта.

Домашнее задание § 23, упр.5