Презентация на тему: Аммиак NH3

Аммиак NH3 КирилловаМаргарита Алексеевнаучитель химии лицея № 369Красносельского района

Строение атома азота. Образование молекулы аммиака.Строение молекулы аммиака. Физические свойства. Способы получения аммиака. Химические свойства аммиака. Образование иона аммония. Свойства солей аммония. Разложение солей аммония при нагревании. Применение аммиака и солей аммония.

Строение атома азота 7N II период V группа На внешнем уровне атома азота – валентные 1s-орбиталь,на которой находятся два спаренных электрона, и три p-орбитали, на каждой из которых по одному неспаренному электрону.

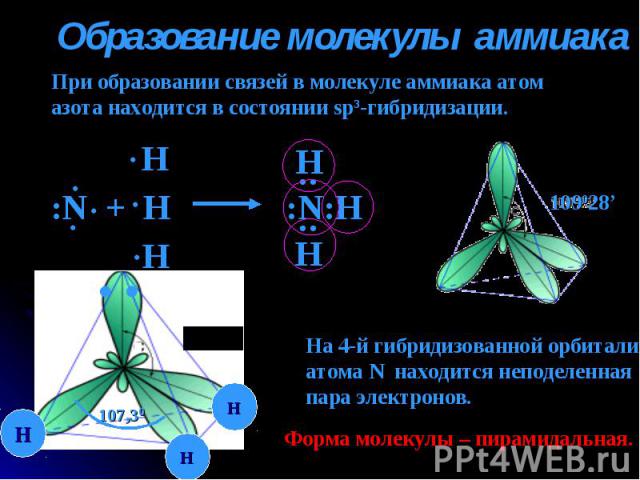
Образование молекулы аммиака При образовании связей в молекуле аммиака атомазота находится в состоянии sp3-гибридизации. На 4-й гибридизованной орбиталиатома N находится неподеленнаяпара электронов. Форма молекулы – пирамидальная.

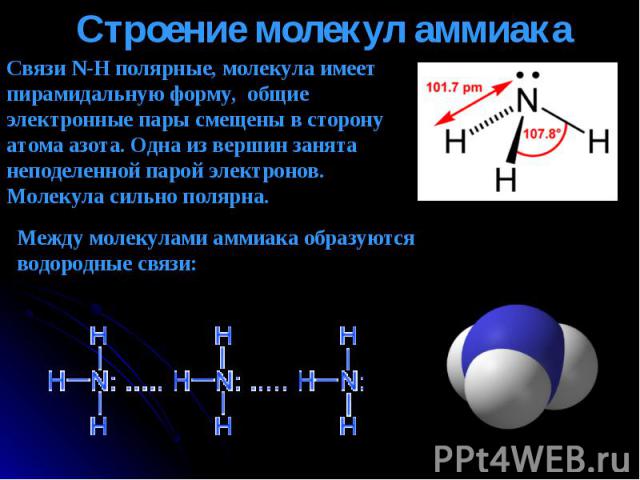
Связи N-H полярные, молекула имеет пирамидальную форму, общие электронные пары смещены в сторону атома азота. Одна из вершин занята неподеленной парой электронов. Молекула сильно полярна. Между молекулами аммиака образуются водородные связи:

Физические свойства аммиака Бесцветный газ с резким запахом. Почти в два раза легче воздуха: При охлаждении до -330С – cжижается. Очень хорошо растворяется в воде, т.к. образуются водородные связи между молекулами аммиака и молекулами воды (в 1V воды растворяется 700 V аммиака. 10%-ный р-р – “нашатырный спирт”. Концентрированный раствор содержит 25% аммиака.

Способы получения аммиака В промышленности: N2 + 3H2 2NH3 Реакция проводится при нагревании, под давлением,в присутствии катализатора. В лаборатории:Действием щелочей на соли аммония: 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O Гидролиз нитридов: Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3

Химические свойства аммиака NH3 – низшая степень окисления азота. 1. Аммиак - восстановитель Реакция горения аммиака: 4NH3 + 3O2 = 2N2 + 6H2O Каталитическое окисление аммиака: 4NH3 + 5O2 = 4NO + 6H2O Аммиаком можно восстановить некоторые неактивные металлы: 3CuO + 2 NH3 = 3Cu + N2 + 3H2O

При растворении аммиака в воде образуется гидрат аммиака, который диссоциирует: NH3 + H2O NH3H2O NH4+ + OH- Изменяет окраску индикаторов:Фенолфталеин – б/цв малиновыйМетилоранж – оранжевый желтыйЛакмус – фиолетовый синий С кислотами образует соли аммония: NH3 + HCl = NH4Cl хлорид аммония 2NH3 + = (NH4)2SO4 сульфат аммония NH3 + H2SO4 = NH4HSO4 гидросульфат аммония
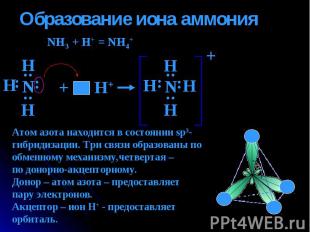
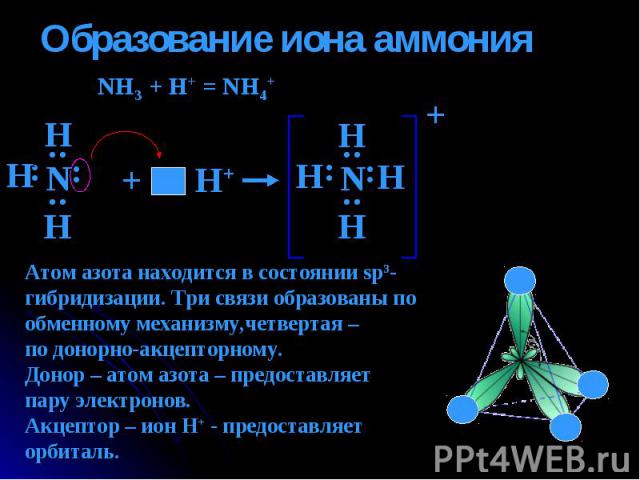
Образование иона аммония NH3 + H+ = NH4+ Атом азота находится в состоянии sp3-гибридизации. Три связи образованы по обменному механизму,четвертая – по донорно-акцепторному.Донор – атом азота – предоставляет пару электронов. Акцептор – ион Н+ - предоставляеторбиталь.

Соли аммония Ион аммония по размерам и заряду близок кионам щелочных металлов, поэтому солиаммония похожи на соли щелочных металлов. Кристаллические вещества. Белого цвета. Хорошо растворяются в воде. Их растворение в воде сопровождается поглощением тепла. Качественная реакция на ион аммония – взаимодействие солей с растворами щелочей: NH4NO3 + NaOH = NaNO3 + NH3 + H2O характерный резкий запах аммиака

Разложение солей аммония при нагревании Соли летучих кислот: NH4Cl = NH3 + HCl (NH4)2CO3 = 2NH3 + CO2 + H2O Cоли нелетучих кислот: (NH4)2SO4 = NH4HSO4 + NH3 (NH4)3PO4 = (NH4)2HPO4 + NH3 без нагревания (NH4)2HPO4 = NH4H2PO4 + NH3 при нагревании Соли с анионом-окислителем: (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O NH4NO3 = N2O + 2H2O NH4NO2 = N2 + 2H2O

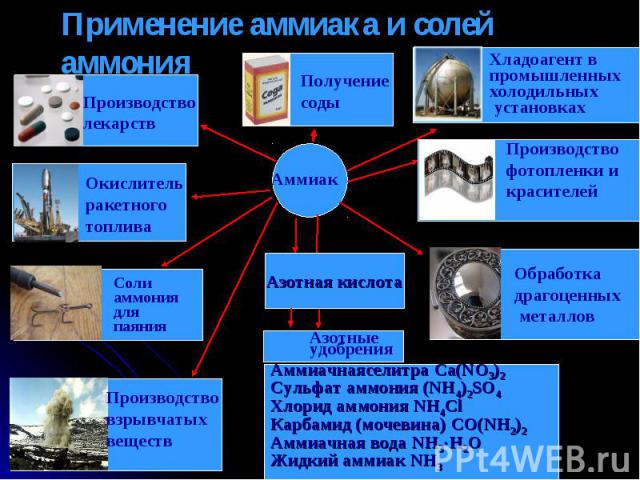
Применение аммиака и солей аммония Аммиачнаяселитра Ca(NO3)2Сульфат аммония (NH4)2SO4Хлорид аммония NH4ClКарбамид (мочевина) CO(NH2)2Аммиачная вода NH3H2OЖидкий аммиак NH3

Благодарю за внимание