Презентация на тему: Аммиак

«Можно не любить химию, но прожить без неё сегодня и завтра нельзя»О.М. Нефёдов Тема урока: Аммиак

Встречаемся с аммиаком Продукт белкового обмена в живых организмах Сегодня аммиак — исключительной важности сырье для производства азотсодержащих веществ, применяемых в сельском хозяйстве, химии, медицине, военном деле. И что не менее важно, он является одним из продуктов белкового обмена в организме.

История открытия аммиака Посредине ливийской пустыни стоял храм, посвященный богу Амон Ра. В древности арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. растирали в ступках, нагревали – и получали едкий газ. Сначала его именовали аммониак, а потом сократили название до «аммиак». В 18 веке аммиак был получен английским химиком Джозефом Пристли. Сегодня аммиак — исключительной важности сырье для производства азотсодержащих веществ, применяемых в сельском хозяйстве, химии, медицине, военном деле. И что не менее важно, он является одним из продуктов белкового обмена в организме.
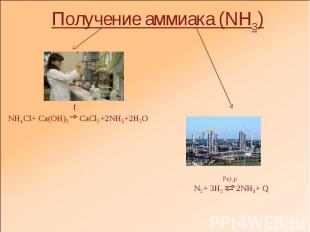
Получение аммиака (NH3) tNH4Cl+ Ca(OH)2 CaCl2+2NH3+2H2O Fe,t,pN2+ 3H2 2NH3+ Q

Физические свойства аммиака NH3 NH3 аммиак - газ: без цвета, с характерным запахом, легче воздуха (собирают в перевёрнутый вверх дном сосуд) NH3 - ЯДОВИТ! Смесь аммиака с воздухом взрывоопасна! Нашатырный спирт – 3-10 % раствор аммиакаАммиачная вода - 18 -25 % раствор аммиака Жидкий аммиак вызывает сильные ожоги кожи; обычно его перевозят в стальных баллонах (окрашены в желтый цвет, имеют надпись "Аммиак" черного цвета)

Строение молекулы аммиака Атом азота за счет своих трех неспаренных электронов образует с атомами водорода 3 ковалентные полярные связи => валентность N равна ІІІ Неподеленная электронная пара атома азота способна участвовать в образовании четвертой ковалентной связи с атомами, имеющими вакантную (свободную) орбиталь по донорно-акцепторному механизму. Валентность N равна ІV Механизм донорно-акцепторной связи:H3N: + H+ = [NH4]+ион аммония

Химические свойства аммиака изменением степени окисления азотаNH3 – сильный восстановитель без изменения степени окисления азотаNH3 – слабое основание 1. аммиак – непрочное соединение, при нагревании разлагается: 2NH3 N2 + 3H2 3. окисление аммиака кислородом воздуха в присутствии катализатора: аммиак реагирует с кислотами:NH3 + HCl → NH4Clхлорид аммония

Добрый старый аммиак,Он богач, и он бедняк,Богат неподеленными своими электронами, Но только, вот беда, емуВ растворе скучно одному.Он погулять готов всегда:Там кислота, а тут вода…Потом, обобранный до нитки,Он плачет: «Где мои пожитки?Какое это беззаконие:Стал катионом я аммония!»