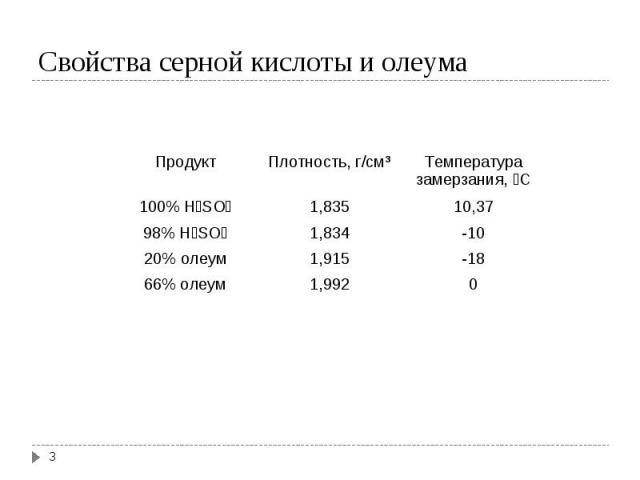
Презентация на тему: СБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ


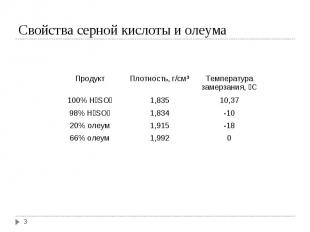
Этот процесс был запатентован в 1831 г. англичанином Филипсом (Philips). Этот процесс был запатентован в 1831 г. англичанином Филипсом (Philips). Смесь SO2 и воздуха направляли на поверхность катализатора с последующей абсорбцией в 98,5-99 % серной кислоте. Патент Филипса не находил промышленного применения почти 40 лет, так как не было достаточных знаний о газовых каталитических реакциях и не было особой потребности в концентрированной кислоте. В настоящее время производят концентрированную Н2SO4, а также олеум (раствор SO3 в Н2SO4) с концентрациями, учитывающими условия складирования и транспорта, т.е. с минимальной температурой замерзания

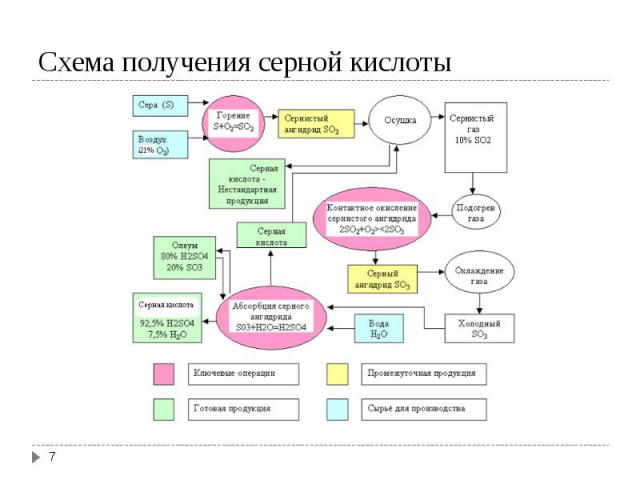
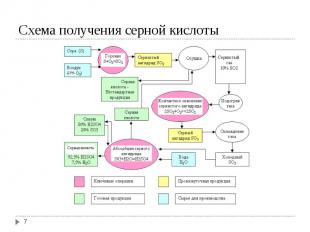
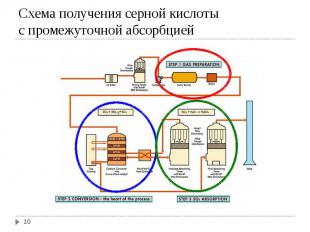
Получение диоксида серы Получение диоксида серы а) Сжигание серы: S (ж) + O2 (г) → SO2 (г); ΔH = -298,3 кДж б) Обжиг колчедана 4FeS₂(т) + 11O₂(г) → 8SO₂(г)+ 2Fe₂O₃ (т); Окисление SO2 в SO3: SO2 + O2 ↔ SO3; ΔH = -98,3 кДж Абсорбция SO3 серной кислотой: SO3 (г)+ H2O (ж) ↔ Н2SO4 (ж); ΔH = -130,4 кДж

Основная реакция - каталитическое окисление SO2 в SO3 - обратимая. Основная реакция - каталитическое окисление SO2 в SO3 - обратимая. Степень конверсии SO2 в SO3 уменьшается с повышением температуры, при более низких температурах (≤ 400ºС, когда можно достичь ≈ 100 %-ного равновесия) скорость реакции слишком мала. В настоящее время процесс проводят в 4-5 слойных каталитических колоннах – каталитических аппаратах. В качестве катализатора до 30-ых годов 20-го века использовали оксиды железа и Pt. В настоящее время применяют ванадиевый катализатор - 7 % V2O5 на поверхности алюмосиликата. Контактные яды – соединения мышьяка

SO3 абсорбируется наилучшим образом не водой, а 98,3 %-ной серной кислотой. SO3 абсорбируется наилучшим образом не водой, а 98,3 %-ной серной кислотой. Такой раствор имеет минимальное парциальное давление как SO3, так и Н2О над раствором. Процесс проводится в двух последовательных колоннах, первую как правило орошают олеумом (18,5-20 % SO3), вторую 98,3 %-ной Н2SO4.
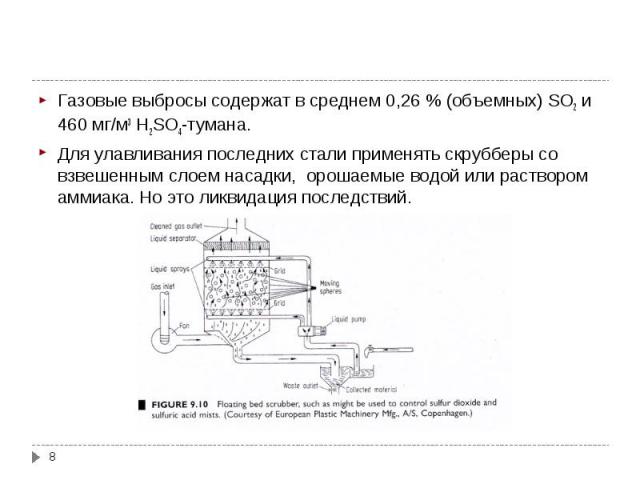
Газовые выбросы содержат в среднем 0,26 % (объемных) SO2 и 460 мг/м3 Н2SO4-тумана. Газовые выбросы содержат в среднем 0,26 % (объемных) SO2 и 460 мг/м3 Н2SO4-тумана. Для улавливания последних стали применять скрубберы со взвешенным слоем насадки, орошаемые водой или раствором аммиака. Но это ликвидация последствий.

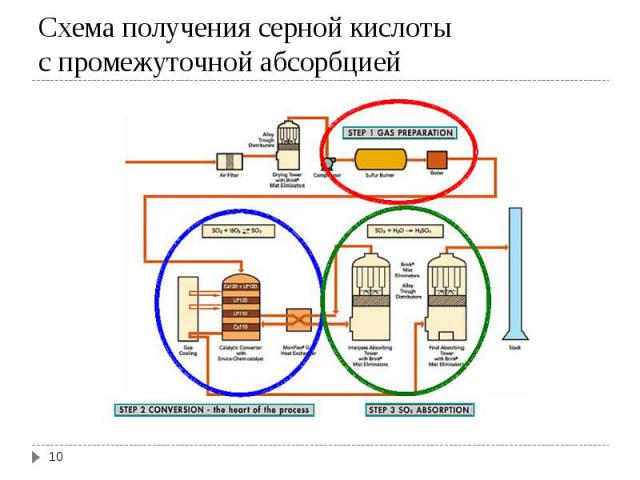
С точки зрения принципа малоотходной технологии наибольший интерес представляет схема с промежуточной абсорбцией. В этом случае газ после прохождения через 3-ий слой катализатора в контактной колонне выводят и направляют в колонну абсорбции с 98%-ной Н2SO4, а потом направляют обратно в контактную колонну перед 4-ым слоем катализатора. С точки зрения принципа малоотходной технологии наибольший интерес представляет схема с промежуточной абсорбцией. В этом случае газ после прохождения через 3-ий слой катализатора в контактной колонне выводят и направляют в колонну абсорбции с 98%-ной Н2SO4, а потом направляют обратно в контактную колонну перед 4-ым слоем катализатора. Цель – выделить возможно большее количество SO3 до последней ступени катализатора, достигая тем самым сильный сдвиг направо равновесия реакции окисления SO2 в SO3. Степень конверсии оксида серы достигает в этом случае до 99,8-99,95 %.


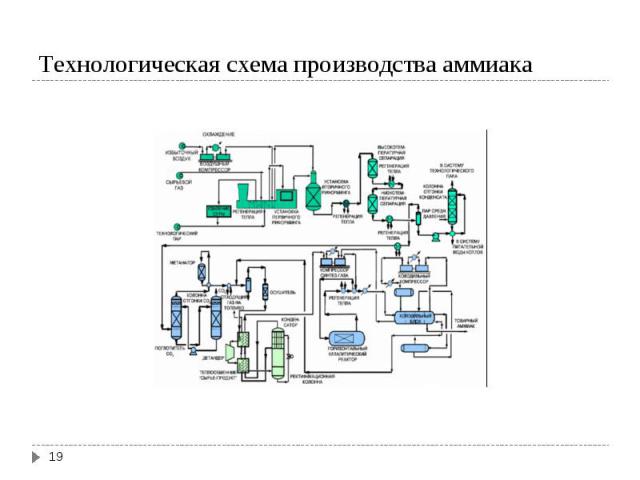
Производство аммиака Производство аммиака Производство азотной кислоты Исторически известны три метода связывания азота и приведения его в форму, усвояемую растениями: Электродуговой метод (60000 кВт·ч/т) N2 + O2 → 2NO; 3000-4000ºС; ΔH = 179,2 кДж Цианамидный метод (12000 кВт·ч/т) CaC2 + N2 → CaCN2 + C; 1000ºС; ΔH = -284,9 кДж Синтез аммиака (4000 кВт·ч/т ) N2 + 3H2 ↔ 2NH3; 400-600ºС; ΔH = -55,7 кДж

Пристли (Priestly) и Кавендиш (Cavendish) в Англии пропускали искры тока через воздух и получили нитраты, растворяя оксиды азота в щелочном растворе. Пристли (Priestly) и Кавендиш (Cavendish) в Англии пропускали искры тока через воздух и получили нитраты, растворяя оксиды азота в щелочном растворе. Первый завод с применением электрической дуги ввели в строй в Ниагаре (США) в 1901 г. В 1905 г. запустили промышленный процесс в Норвегии: N₂ → NO → NO2 → Ca(NO3) Цианамидный процесс в промышленном масштабе внедрили в 1905 г. в Италии.

Немецкие химики Фриц Габер и Вальтер Нернст (Haber & Nernst) работали над теоретическими основами синтеза аммиака NH3 10 лет и были в 1918 г. награждены Нобелевской премией по химии «за синтез аммиака из составляющих его элементов». Немецкие химики Фриц Габер и Вальтер Нернст (Haber & Nernst) работали над теоретическими основами синтеза аммиака NH3 10 лет и были в 1918 г. награждены Нобелевской премией по химии «за синтез аммиака из составляющих его элементов». Карл Бош (K. Bosch ) – создатель промышленного способа синтеза аммиака Первый завод синтеза аммиака (20-25 т NH3 в сутки, 200-225 атм) запустили в 1913 г. в Германии.

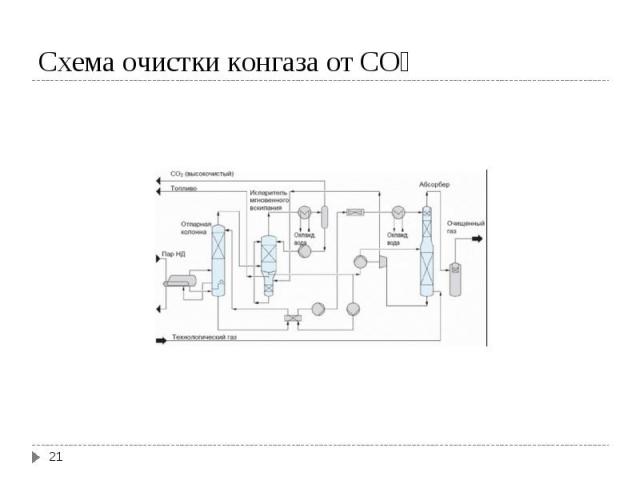
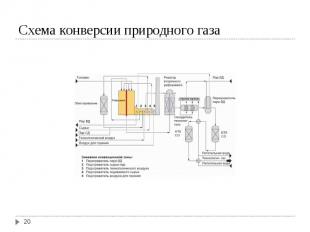
Для синтеза NH3 надо иметь смесь N2 и H2 со стехиометрическим соотношением 1N2 : 3H2. Для синтеза NH3 надо иметь смесь N2 и H2 со стехиометрическим соотношением 1N2 : 3H2. Водород можно получить 4-мя способами: Конверсией метана (СН4) Конверсией СО, полученной при газификации твердого топлива (водяной газ) Из коксового газа (~ 59 % Н2) Электролизом воды Источником азота является воздух

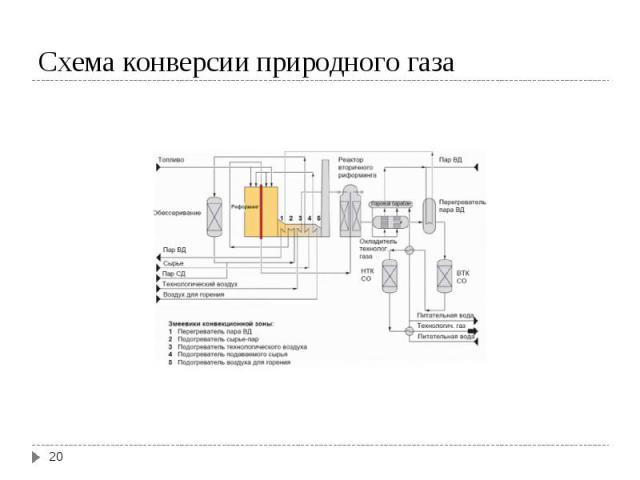
Конверсия метана Конверсия метана I ступень СН4 + H2O ↔ CO + 3 H2; ΔH = 206 кДж II ступень СН4 + 0,5 O2 ↔ CO + 2H2; ΔH = - 35 кДж Конверсия СО CO + H2O ↔ CO2 + H2; ΔH = - 41 кДж Суммируя процесс конверсии метана с водяным паром: СН4 + H2O ↔ CO2 + 3 H2; ΔH = 165 кДж Условия конверсии метана: 800-1000ºС в присутствии Ni-Al2O3 катализатора при давлении 30 атм. Остаточное содержание метана в газе 0,5% Условия конверсии СО: в присутствии Zn-Cr-Cu катализатора, температура 200-400ºС, давление 30 атм. Остаточное содержание СО в газе 0,2-0,4 %.

N2 + 3 H2 ↔ 2NH3 (г); ΔH = -55,6 кДж Выход NH3 увеличивается значительно при повышенных давлениях. Катализатором является металлическое дисперсное железо. В качестве промоторов (веществ, увеличивающих активность катализатора) добавляют оксиды Al, Zr, Si.

Технологические схемы разделяют на: Технологические схемы разделяют на: низкого давления (100-200 атм) среднего давления (200-350 атм) высокого давления (500-1000 атм) Наиболее распространены схемы среднего давления Принципиальное различие схем состоит в сепарации (выделении) аммиака. При низком и среднем давлении нужно 2-ступенчатое охлаждение (холодной водой и жидким аммиаком). При высоком давлении достаточно водяного охлаждения.
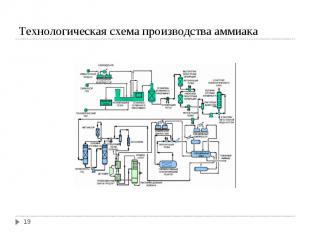
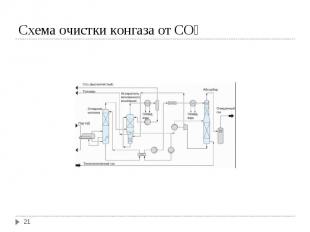

Степень превращения АВС в аммиак невысокая (16-30 %). Непрореагировавшие N2 и H2 рециркулируют. Степень превращения АВС в аммиак невысокая (16-30 %). Непрореагировавшие N2 и H2 рециркулируют. Периодически проводится продувка системы для удаления инертных примесей (CH₄; Ar).


Начиная со средневековья азотную кислоту получали из селитры (KNO3) и серной кислоты. Начиная со средневековья азотную кислоту получали из селитры (KNO3) и серной кислоты. KNO3 + H2SO4 → KHSO4 + HNO3 В 19-ом веке KNO3 заменили селитрой из Чили NaNO3: NaNO3 + H2SO4 → NaHSO4 + HNO3

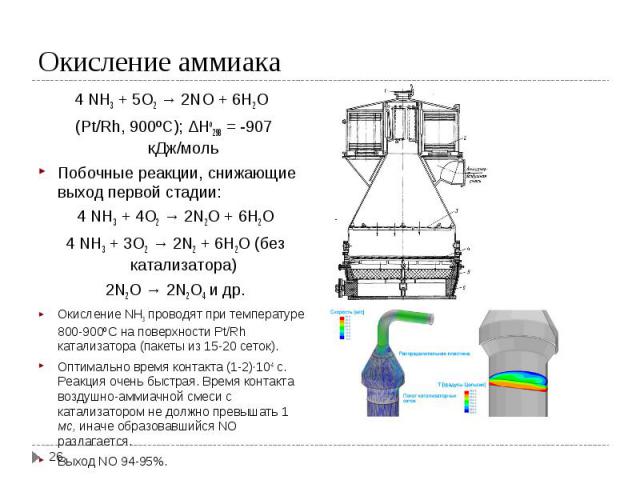
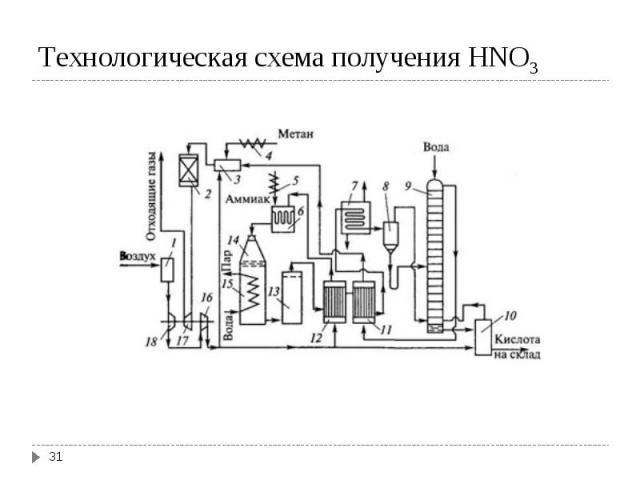
I стадия – окисление аммиака I стадия – окисление аммиака 4 NH3 + 5O2 → 2NO + 6H2O (Pt/Rh, 900ºС); ΔHo298 = -907 кДж/моль II стадия – окисление NO 2NO + O2 → 2NO2; ΔHo298 = -113 кДж/моль IIIстадия – абсорбция NO2 2NO2 + H2O→ 2HNO3 + NO; ΔHo298 = -138 кДж/моль Суммарная реакция: NH3 + O2 →2HNO3 + H2O; ΔHo298 = -330 кДж/моль Все реакции необратимы. Концентрация полученной кислоты зависит от применяемого давления и от противодавления NO над раствором кислоты.
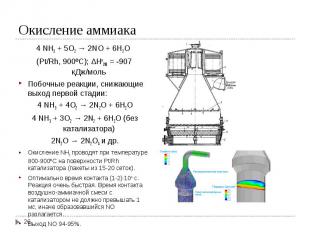
4 NH3 + 5O2 → 2NO + 6H2O 4 NH3 + 5O2 → 2NO + 6H2O (Pt/Rh, 900ºС); ΔHo298 = -907 кДж/моль Побочные реакции, снижающие выход первой стадии: 4 NH3 + 4O2 → 2N2O + 6H2O 4 NH3 + 3O2 → 2N2 + 6H2O (без катализатора) 2N2O → 2N2O4 и др. Окисление NH3 проводят при температуре 800-900ºС на поверхности Pt/Rh катализатора (пакеты из 15-20 сеток). Оптимально время контакта (1-2)·10-4 с. Реакция очень быстрая. Время контакта воздушно-аммиачной смеси с катализатором не должно превышать 1 мс, иначе образовавшийся NO разлагается. Выход NO 94-95%.

Самая медленная и аномальная по отношению к температуре: повышение температуры снижает скорость! Причина в том, что реакция проходит в две ступени: 2NO ↔ (NO)2 ΔH<0 (NO)2 + O2 ↔ 2NO₂ (самая медленная стадия) Повышение температуры снижает по первой реакции выход димера (NO)2 и тем самым скорость второй, самой медленной стадии.

2NO2 + H2O→ 2HNO3 + NO; ΔHo298 = -138 кДж/моль Процесс осуществляют в насадочных или тарельчатых колоннах со значительными межтарелочными объемами.

Технологические схемы производства разбавленной азотной кислоты разделяют на: Технологические схемы производства разбавленной азотной кислоты разделяют на: схемы под атмосферным давлением. Для абсорбции нитрозных газов используют 3-4 насадочные башни и получают 47-50 % НNO3. схемы повышенного давления (10-12 атм). В качестве абсорбера используется одна тарельчатая колонна из нержавеющий стали; получают 52-65 % НNO3. комбинированные схемы (окисление NH3 приосходит под атмосферным давлением для сохранения катализатора, абсорбция NOх под давлением (~ 10 атм); получают 60-62 % НNO3.

Дистилляцией разбавленной азотной кислоты может быть получена азотная кислота азеотропного состава (69,2% HNO3). Более концентрированную кислоту (до 100% ) получают перегонкой растворов азотной кислоты с концентрированной H2SO4 или прямым синтезом - взаимодействием N2O4 с водой (или разбавленной азотной кислотой) и кислородом: 2N2O4 + 2H2O + O2 → 4HNO3
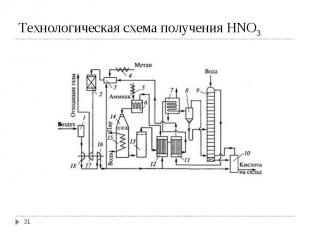

По требованиям к защите окружающей среды концентрация NOх в выходящем газе не должна превышать 200-300 ppm (vol). По требованиям к защите окружающей среды концентрация NOх в выходящем газе не должна превышать 200-300 ppm (vol). Фактически концентрация NOх доходит до 2000-3000 ppm (vol). В настоящее время можно выбирать между следующими методами для снижения выбросов NOх: SCR – селективное каталитическое восстановление NSCR– неселективное каталитическое восстановление EA – удлиненная абсорбция (extended absorption).