Презентация на тему: Активные фармацевтические ингредиенты

Активные фармацевтические ингредиенты (AФИ) (с акцентом на лекарственные средства для лечения пациентов с ВИЧ/СПИД и туберкулезом) Всемирная организация здравоохранения Семинар «Качество, GMP и биоэквивалентность лекарственных средств» Киев, Украина 3-7 октября 2005 г. Theo Dekker, D.Sc., consultant to WHO Research Institute for Industrial Pharmacy North-West University, Potchefstroom, South Africa [email protected] 900igr.net * TG Dekker – WHO, Ukraine October 2005

Что такое API? Активный фармацевтический ингредиент (AФИ) Вещество или соединение, предназначенное для использования при производстве лекарственного средства в качестве терапевтически активного соединения (ингредиента). «Выдача разрешений на маркетинг лекарственных препаратов с акцентом на многоисточниковые (генерические) препараты» — Руководствe ВОЗ для органов по регулированию оборота лекарственных средств (WHO Blue Book — Синяя книга ВОЗ) * TG Dekker – WHO, Ukraine October 2005

Основные направления презентации Сбор и интерпретация доступной информации относительно AФИ (исследования перед составлением досье), например: Возможный производитель(ли) Литература, все аспекты (химические/физические) Фармакопейные монографии (например, АРВ-препараты) Требования к досье для AФИ Руководство, стр. 4 - 9 * TG Dekker – WHO, Ukraine October 2005

Часть 1. Доступная информация об API (для производителей API и/или FPP) Почему так важно осуществлять сбор и анализ доступной информации об AФИ на систематической основе? Некоторые результаты: Глубокое научное понимание AФИ , в разрезе их свойств, стабильности, спецификаций, etc. Содействие производству AФИ и составлению мастер-файла (Drug Master File — DMF) препарата Возможность полноценного выбора производителя API (источника) Помощь при составлении досье Значение для фармацевтической разработки ГЛС Экономия времени / денег * TG Dekker – WHO, Ukraine October 2005

Информация о потенциальных производителях AФИ Решение по поводу выбора производителя AФИ должно быть сформировано перед началом или на самых ранних стадиях исследоавний по разработке ГЛС Необходимость в последующих изменениях может быть вполне оправдана Заслуживает ли производитель доверия? Его репутация Лицензия на производство и соответствие GMP? Доступна ли для ознакомления открытая часть DMF и соответствует ли она всем требованиям? Имеется ли валидный CEP? Соответствует ли AФИ требуемым стандартам качества? * TG Dekker – WHO, Ukraine October 2005

Литературные источники Узнайте о своем AФИ,используя: Руководства / серии / книги – в том числе: (Аналитические) Параметры лекарственных субстанций и вспомогательных веществ — [eds: Florey / Brittain – 31 том] The Merck Index (по структуре, свойствам) Pharmaceutical Codex (12е издание) (“старые” AФИ) Журналы через поисковые системы, в том числе Международные фармацевтические, химические, аналитические «абстракты» и интернет Фармакопейные монографии (действующие) Структурный анализ и стереохимия * TG Dekker – WHO, Ukraine October 2005

Примеры информации об AФИ, представленной в фармакопеях и некоторых руководствах Таблицы на следующих страницах демонстрируют, какие фармакопеи и какие руководства содержат информацию об AФИ для лечения: TB (6th EOI), ВИЧ/СПИД (6th EOI) and Малярия (4th EOI) Аббревиатуры: BP British Pharmacopoeia: 2004, addendum 2005 EP European Pharmacopoeia: 5.12 (July 2005) US USP 28, second supplement (August 2005) Int International Pharmacopoeia: 3rd edition (4th due) MI Merck Index (13th ed, 2001) JP Japanese Pharmacopoeia (web; December 2001) Apr Analytical Profiles of Drug Substances and Excipients to vol. 31 (name of series changed twice) Cod Pharmaceutical Codex (12th ed, 1994) (“old APIs) * TG Dekker – WHO, Ukraine October 2005
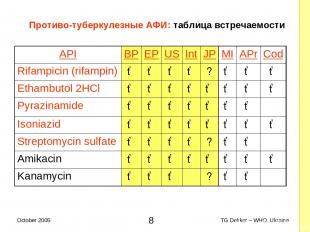
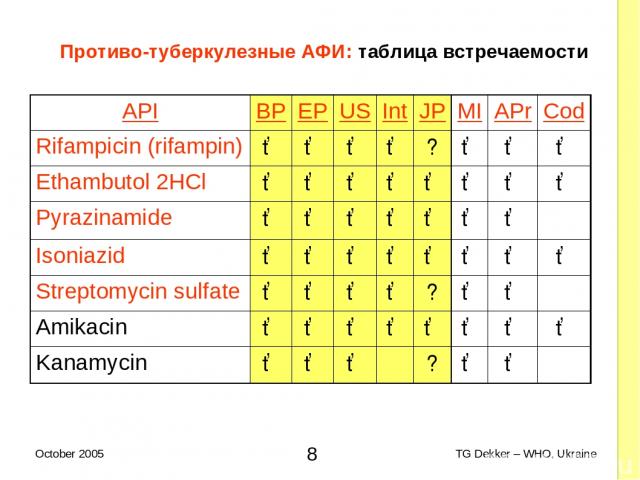
Противо-туберкулезные AФИ: таблица встречаемости API BP EP US Int JP MI APr Cod Rifampicin (rifampin) ✓ ✓ ✓ ✓ ? ✓ ✓ ✓ Ethambutol 2HCl ✓ ✓ ✓ ✓ ✓ ✓ ✓ ✓ Pyrazinamide ✓ ✓ ✓ ✓ ✓ ✓ ✓ Isoniazid ✓ ✓ ✓ ✓ ✓ ✓ ✓ ✓ Streptomycin sulfate ✓ ✓ ✓ ✓ ? ✓ ✓ Amikacin ✓ ✓ ✓ ✓ ✓ ✓ ✓ ✓ Kanamycin ✓ ✓ ✓ ? ✓ ✓ * TG Dekker – WHO, Ukraine October 2005
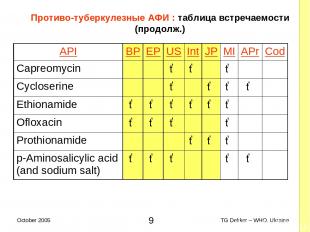
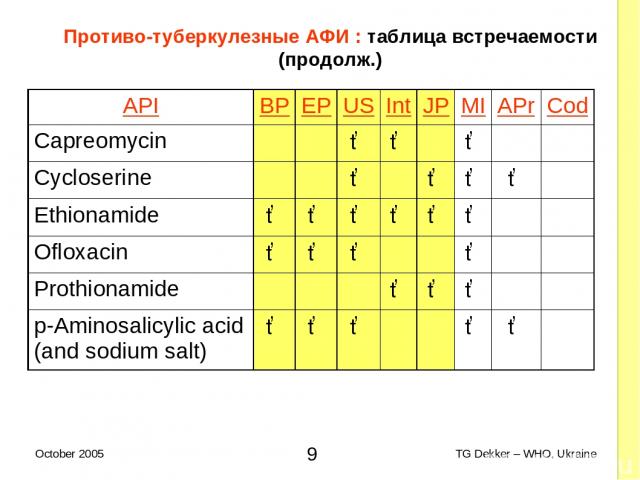
Противо-туберкулезные AФИ : таблица встречаемости (продолж.) API BP EP US Int JP MI APr Cod Capreomycin ✓ ✓ ✓ Cycloserine ✓ ✓ ✓ ✓ Ethionamide ✓ ✓ ✓ ✓ ✓ ✓ Ofloxacin ✓ ✓ ✓ ✓ Prothionamide ✓ ✓ ✓ p-Aminosalicylic acid (and sodium salt) ✓ ✓ ✓ ✓ ✓ * TG Dekker – WHO, Ukraine October 2005
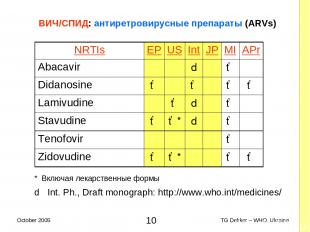
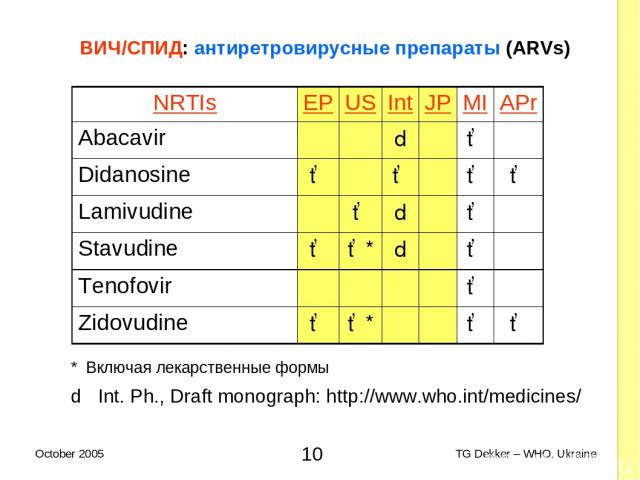
ВИЧ/СПИД: антиретровирусные препараты (ARVs) * Включая лекарственные формы d Int. Ph., Draft monograph: http://www.who.int/medicines/ NRTIs EP US Int JP MI APr Abacavir d ✓ Didanosine ✓ ✓ ✓ ✓ Lamivudine ✓ d ✓ Stavudine ✓ ✓* d ✓ Tenofovir ✓ Zidovudine ✓ ✓* ✓ ✓ * TG Dekker – WHO, Ukraine October 2005
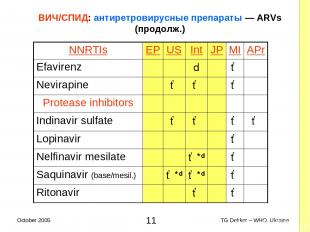
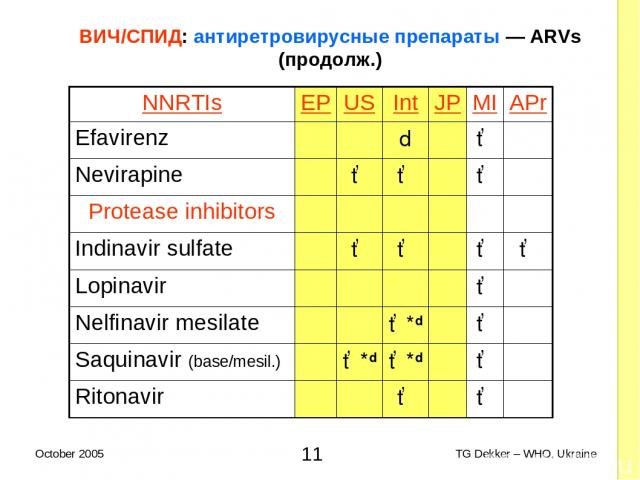
ВИЧ/СПИД: антиретровирусные препараты — ARVs (продолж.) NNRTIs EP US Int JP MI APr Efavirenz d ✓ Nevirapine ✓ ✓ ✓ Protease inhibitors Indinavir sulfate ✓ ✓ ✓ ✓ Lopinavir ✓ Nelfinavir mesilate ✓*d ✓ Saquinavir (base/mesil.) ✓*d ✓*d ✓ Ritonavir ✓ ✓ * TG Dekker – WHO, Ukraine October 2005

ВИЧ/СПИД : противомикробные AФИ Для большинства AФИ перечисленных ниже фармакотерапевтических направлений существуют монографии: Антибактериальные и противотуберкулезные средства (кроме MTB) (8) Антипротозойные и противогрибковые средства (9) Противовирусные средства (2) Противоопухолевые средства (4) Лекарственные средства, применяемые для паллиативного лечения онкологических заболеваний (6) Итого 29 AФИ * TG Dekker – WHO, Ukraine October 2005
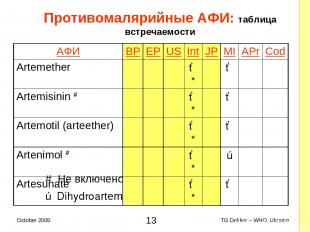
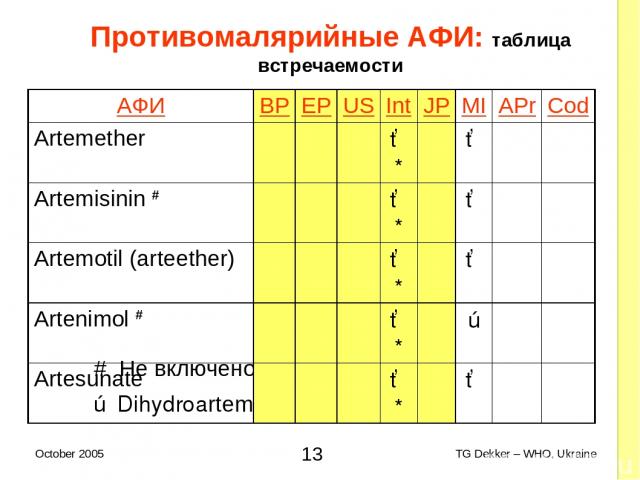
Противомалярийные AФИ: таблица встречаемости # Не включено в 4ую EOI ✗ Dihydroartemisinin (Artemisinin) AФИ BP EP US Int JP MI APr Cod Artemether ✓* ✓ Artemisinin # ✓* ✓ Artemotil (arteether) ✓* ✓ Artenimol # ✓* ✗ Artesunate ✓* ✓ * TG Dekker – WHO, Ukraine October 2005
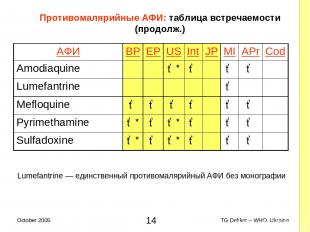
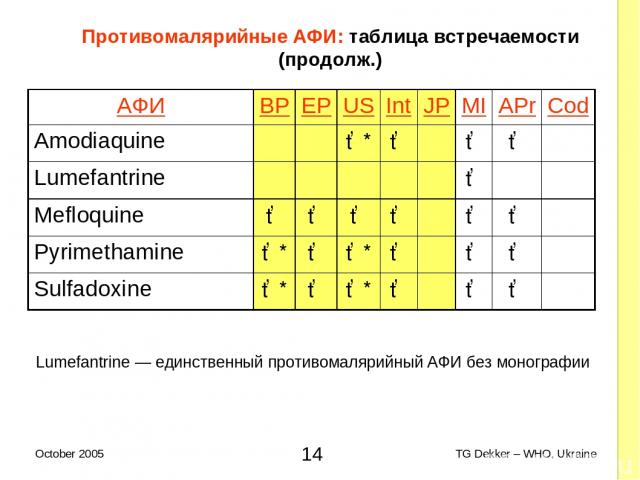
Противомалярийные AФИ: таблица встречаемости (продолж.) Lumefantrine — единственный противомалярийный AФИ без монографии AФИ BP EP US Int JP MI APr Cod Amodiaquine ✓* ✓ ✓ ✓ Lumefantrine ✓ Mefloquine ✓ ✓ ✓ ✓ ✓ ✓ Pyrimethamine ✓* ✓ ✓* ✓ ✓ ✓ Sulfadoxine ✓* ✓ ✓* ✓ ✓ ✓ * TG Dekker – WHO, Ukraine October 2005

Монографии AФИ : резюме Противо-туберкулезные AФИ Монографии для всех APIs ВИЧ/СПИД: AРВ AФИ: Монографии для 9 из 13 внесенных в перечень EOI Разрабатываются быстрыми темпами, недостающие ожидаются в ближайшее время Противомалярийные AФИ Монографии для всех AФИ группы artemisinin Монографии для всех остальных, включенных в перечень EOI кроме lumefantrine * TG Dekker – WHO, Ukraine October 2005

Данные научной литературы и структура AФИ органического происхождения имеют уникальную химическую структуру и стереохимическое строение От этой структуры, находящейся в твердом/жидком агрегатном состоянии, главным образом зависят химические и физические свойства AФИ * TG Dekker – WHO, Ukraine October 2005
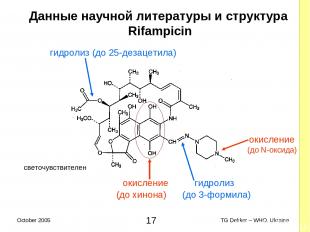
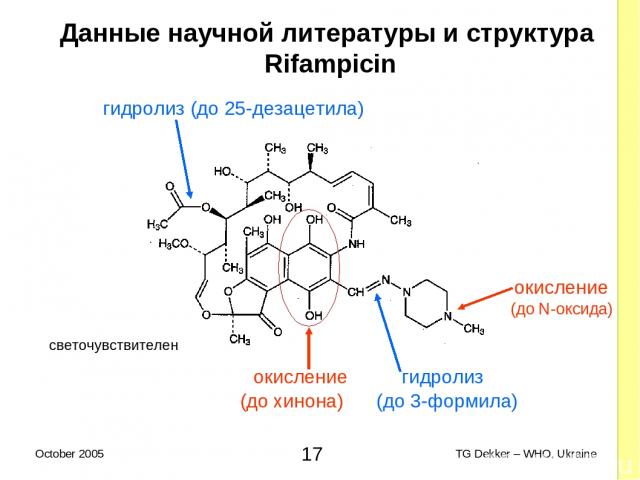
Данные научной литературы и структура Rifampicin гидролиз (дo 25-дезацетила) (до N-оксида) окисление гидролиз (до хинона) (до 3-формила) окисление светочувствителен * TG Dekker – WHO, Ukraine October 2005

Данные научной литературы и структура Rifampicin (дискуссия - 1) Окисление Группа гидрохинона Полный распад AФИ (до рифампицина хинона) Усиление растворимости в щелочной среде Третичные амины Подвергаются постепенному окислению (до оксида азота) Усиление растворимости в кислой среде Окисление активизируется в присутствии Ионов металлов При низком pH * TG Dekker – WHO, Ukraine October 2005

Данные научной литературы и структура Rifampicin (дискуссия - 2) Гидролиз Группа гидрохинона (имина) Гидролиз до 3-formyl rifampycin Группа 25-acetyl (эфир) Гидролиз до 25-desacetyl rifampicin (в меньшей степени) Светочувствительность По причине конъюгации внутри молекул (ненасыщенность) Хранение исходных материалов и продукции in bulk (BP/Ph.Eur.): Хранить в герметичных контейнерах, в защищенном от света месте при температуре ≤ 25ºC * TG Dekker – WHO, Ukraine October 2005
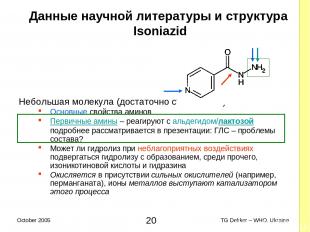
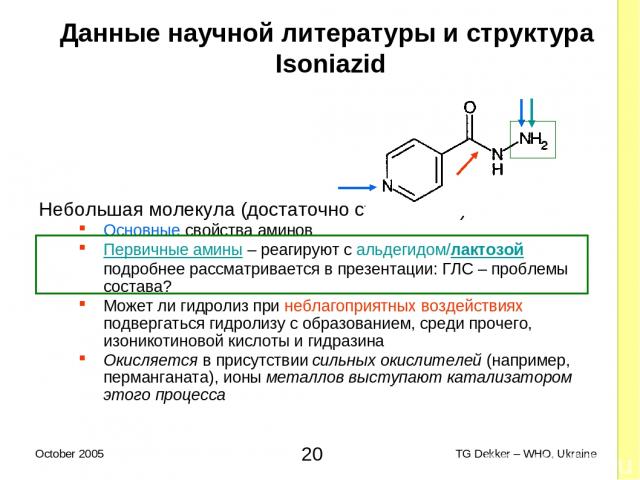
Данные научной литературы и структура Isoniazid Небольшая молекула (достаточно стабильная) Основные свойства аминов Первичные амины – реагируют с альдегидом/лактозой подробнее рассматривается в презентации: ГЛС – проблемы состава? Может ли гидролиз при неблагоприятных воздействиях подвергаться гидролизу с образованием, среди прочего, изоникотиновой кислоты и гидразина Окисляется в присутствии сильных окислителей (например, перманганата), ионы металлов выступают катализатором этого процесса * TG Dekker – WHO, Ukraine October 2005
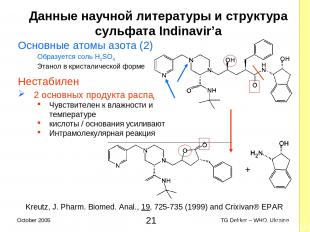
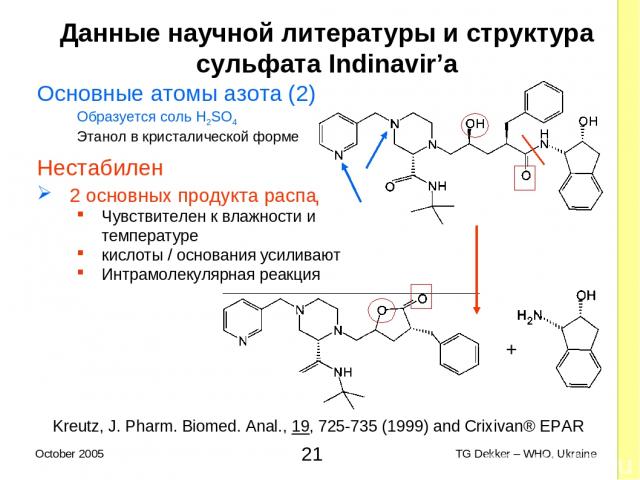
Данные научной литературы и структура сульфата Indinavir’a Основные атомы азота (2) Образуется соль H2SO4 Этанол в кристалической форме Нестабилен 2 основных продукта распада Чувствителен к влажности и температуре кислоты / основания усиливают Интрамолекулярная реакция + Kreutz, J. Pharm. Biomed. Anal., 19, 725-735 (1999) and Crixivan® EPAR * TG Dekker – WHO, Ukraine October 2005

Оформление ссылок на библиографию Приводимые в досье литературные данные всегда следует снабжать: Четко приведенными ссылками на цитируемые источники, например: Devani, M.B., Shishoo, C.J., Doshi, K.J. & Patel, H.B. Kinetic studies of the interaction between isoniazid and reducing sugars. Journal of Pharmaceutical Sciences, 74, 427-432 (1985) Hassan, M.M.A., Jado, A.I., & Zubair, M.U. Aminosalicylic acid. In Florey, K., ed. Analytical Profiles of Drug Substances, vol. 10. New York: Academic Press, p. 1-27 (1981) Фотокопиями публикаций или отдельных страниц * TG Dekker – WHO, Ukraine October 2005

Раздел 2. Требования к досье для активного фармацевтического ингредиента (AФИ) Опирается на раздел 2 руководства: «Пособие по предоставлению документации для преквалификации готовых многоисточниковых лекарственных препаратов (ГЛС), используемых для лечения пациентов с ВИЧ/СПИДом, малярией и туберкулезом» (Основное руководство, настольная книга) Со стр. 4/50 * TG Dekker – WHO, Ukraine October 2005

AФИ: содержание досье 4/50 2.1 Номенклатура (INN, систематизация etc.) 4/50 ■ 2.2 Свойства (структура, стереохимия etc.) 4/50 ** 2.3 Линия производства 5/50 ■ 2.4 Метод синтеза (примеси etc.) 5/50 ** 2.5 Спецификации 6/50 ** 2.6 Система герметизации контейнеров (упаковка) 7/50 ■ 2.7 Испытания стабильности 8/50 ■ См. руководства – не дискутабельно ** Требования могут отличаться в зависимости от того, когда AФИ был описан в официально принятой фармакопее * TG Dekker – WHO, Ukraine October 2005

Раздел 2. Формат информации об AФИ 4/50 Один из следующих вариантов (по предпочтительности) Валидный CEP (Европейский сертификат стабильности) Со всеми приложениями Предоставить информацию, которую не охватывает CEP, в отношении пунктов 2.2.2, 2.5.2, 2.6 и 2.7 Открытая часть DMF (Мастер файл лекарств) Составляет производитель AФИ DMF должен содержать все виды информации, перечисленные в разделе 2 Заполнение раздела 2 (заявителем) Подача подписанного производителем AФИ подтверждения того, что синтез и надлежащая очистка проведены в соответствии с описанием в досье * TG Dekker – WHO, Ukraine October 2005

2.2 Свойства AФИ 4/50 Три сценария: 2.2.1 AФИ, не описанные в BP, Ph., JP, Ph.Eur., или USP (non-compendial — «нефармакопейные»)) 2.2.2 API, описанные в BP, Int.Ph., JP, Ph.Eur., или USP («фармакопейные») 2.2.3 Литературные данные (важно) См. примеры, приводимые в остальных презентациях В ходе 6го Обновления EOI все противо-TБ AФИ были отнесены к категории 2.2.2 В ходе 6го Обновления EOI некоторые AРВ AФИ были отнесены к категории 2.2.2 * TG Dekker – WHO, Ukraine October 2005

2.2.1 Свойства некомпендиальных AФИ 4/50 Доказательства структурного/стереохимического соответствия Рентгенструктурное исследование монокристаллов (достаточно) или Спектрометрические данные (IR, 1H & 13C NMR, MS, etc.): обеспечение качества удостоверяют копии спектральных и табличных данных с: Распределением по структуре или Сопоставлением полученных спектрометрических данных об AФИ с данными научной литературы, предпочтительно касающимися инновационного препарата (в таблетированной форме!!). Очень рекомендуется! Физико-химические свойства, как рассмотрено в параграфе 2.2.2 (следующий слайд) * TG Dekker – WHO, Ukraine October 2005

2.2.2 Свойства КОМПЕНДИАЛЬНЫХ AФИ 4/50 Физико-химические и другие соответствующие свойства, в частности Растворимость в воде (зависит от pH), других растворителях: эфире, этаноле, ацетоне дихлорметане pKa, коэффициент диффузного разделения Существование/отсутствие полиморфизма и псевдополиморфизма, например, сольватов (при помощи XRPD, DSC, инфракрасный спектр) Рассматривается в презентации по ГЛС (rifampicin) Рассматривается ниже (nevirapine) Гигроскопичность: см. презентацию ГЛС Ethambutol hydrochloride в таблетках 4 сочетаний фиксированной дозы FDC Размер частиц * TG Dekker – WHO, Ukraine October 2005
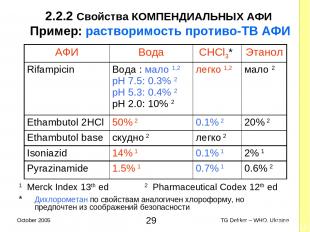
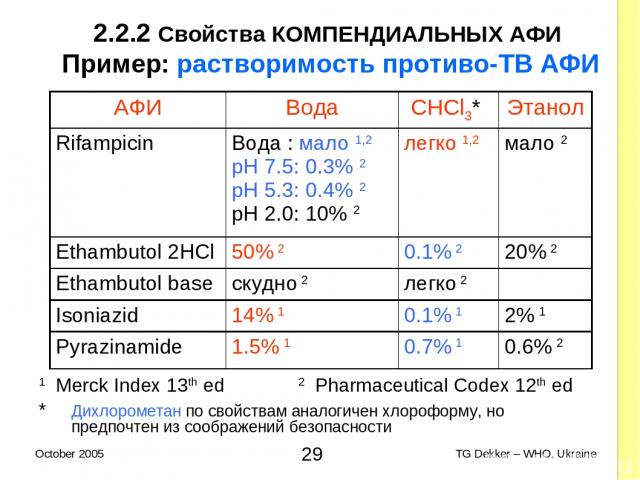
2.2.2 Свойства КОМПЕНДИАЛЬНЫХ AФИ Пример: растворимость противо-ТВ AФИ 1 Merck Index 13th ed 2 Pharmaceutical Codex 12th ed * Дихлорометан по свойствам аналогичен хлороформу, но предпочтен из соображений безопасности AФИ Вода CHCl3* Этанол Rifampicin Вода : мало 1,2 pH 7.5: 0.3% 2 pH 5.3: 0.4% 2 pH 2.0: 10% 2 легко 1,2 мало 2 Ethambutol 2HCl 50% 2 0.1% 2 20% 2 Ethambutol base скудно 2 легко 2 Isoniazid 14% 1 0.1% 1 2% 1 Pyrazinamide 1.5% 1 0.7% 1 0.6% 2 * TG Dekker – WHO, Ukraine October 2005
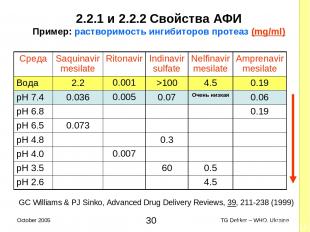
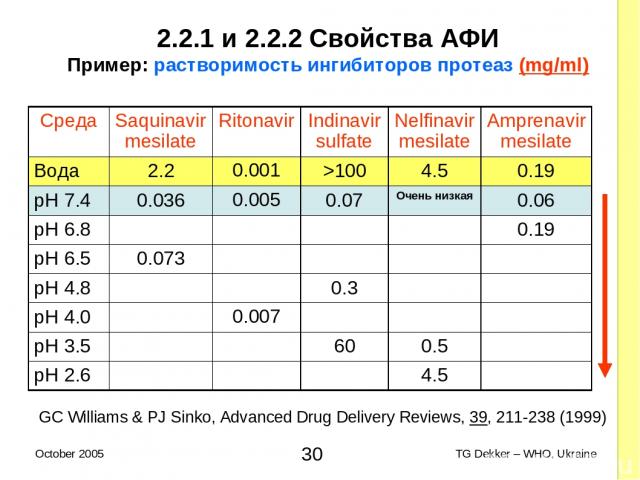
2.2.1 и 2.2.2 Свойства AФИ Пример: растворимость ингибиторов протеаз (mg/ml) GC Williams & PJ Sinko, Advanced Drug Delivery Reviews, 39, 211-238 (1999) Среда Saquinavir mesilate Ritonavir Indinavir sulfate Nelfinavir mesilate Amprenavir mesilate Вода 2.2 0.001 >100 4.5 0.19 pH 7.4 0.036 0.005 0.07 Очень низкая 0.06 pH 6.8 0.19 pH 6.5 0.073 pH 4.8 0.3 pH 4.0 0.007 pH 3.5 60 0.5 pH 2.6 4.5 * TG Dekker – WHO, Ukraine October 2005

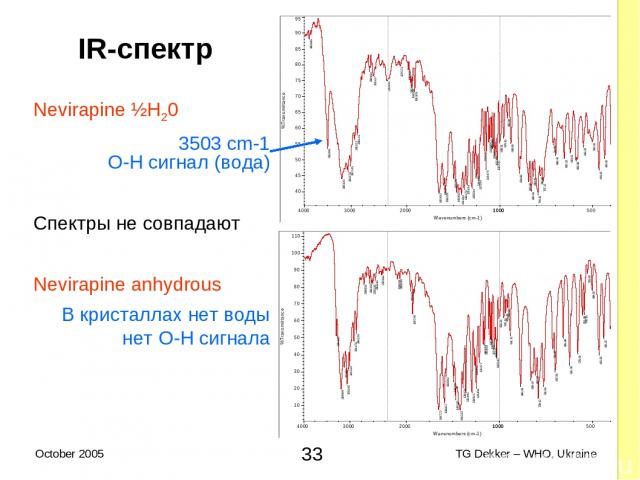
2.2.2 Свойства ФАРМАКОПЕЙНЫХ AФИ Псевдополиморфизм невирапина (1) Монография невирапина (безводный гемигидрат) в Int. Ph. (цитата) Проводите исследования, как описано в: «Спектрофотометрия в инфракрасном поле». Для безводных веществ инфракрасный (IR) спектр поглощения соответствует спектру, полученному у безводного невирапина RS или референтному спектру безводного невирапина Для гемигидрата, IR спектр поглощения демонстрирует параметры острой поглощательности около 3503 cm−1; после нагревания исследуемого вещества на протяжении часа до темепературы 140°C и последующего охлаждения, IR спектр поглощения соответствует спектру, полученному у безводного невирапина RS или референтному спектру безводного невирапина * TG Dekker – WHO, Ukraine October 2005

2.2.2 Свойства КОМПЕНДИАЛЬНЫХ AФИ Псевдополиморфизм невирапина (2) Интерпретация результатов этого IR-идентифицируемого исследования: Невирапина ангидрид (один анализ) IR спектр невирапина ангидрида RS Невирапина гемигидрат (два теста, соответствует обоим) IR спектр генерирует сигнал на уровне 3503 cm-1 (вода) и Под влиянием высокой температуры гемигидрат преобразуется в форму ангидрида IR спектр невирапина ангидрида RS - ½H20 Nevirapine, ½H20 ————> Nevirapine жар При комнатной температуре реакция необратима * TG Dekker – WHO, Ukraine October 2005
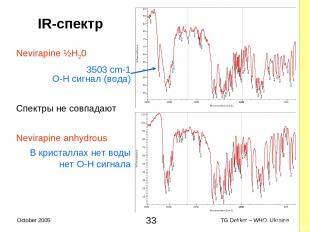
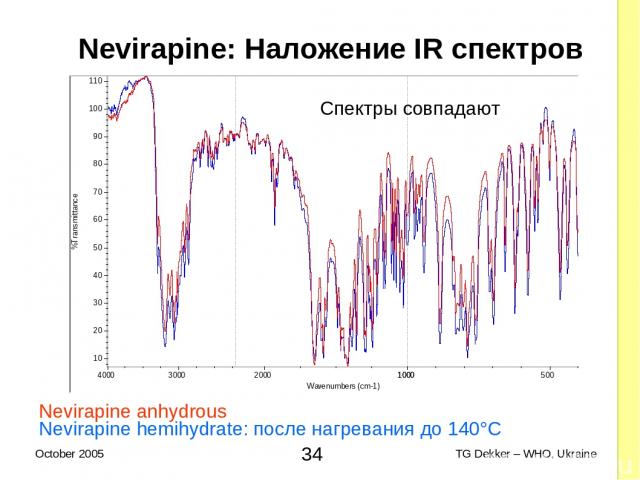
IR-спектр Nevirapine ½H20 3503 cm-1 O-H сигнал (вода) Спектры не совпадают Nevirapine anhydrous В кристаллах нет воды нет O-H сигнала * TG Dekker – WHO, Ukraine October 2005
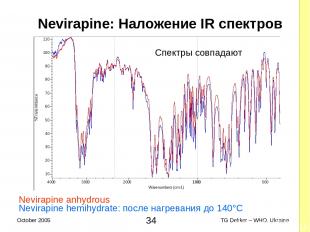
Nevirapine: Наложение IR спектров Nevirapine anhydrous Nevirapine hemihydrate: после нагревания до 140°C Спектры совпадают * TG Dekker – WHO, Ukraine October 2005

2.4 Путь (пути) синтеза 5/50 Три сценария: 2.4.1 AФИ не описан в BP, Int.Ph., JP, Ph.Eur., или USP (нефармакопейный AФИ) 2.4.2 Спецификации исходных материалов и промежуточных веществ, используемых при синтезе некомпендиальных APIs 2.4.3 AФИ опсиан в BP, Int.Ph., JP, Ph.Eur., или USP (фармакопейный AФИ) * TG Dekker – WHO, Ukraine October 2005

2.4 Путь (пути) синтеза (продолж.) Требования: синтез должен Закончится правильной структурой, стереохимией и кристаллической формой и объемом (если нужно) Проходить под надлежащим контролем и быть провалидирован (GMP) Создать АФИ, которое соответствует принятым стандартам качества в том числе с учетом пределов примесей (oрганических, неoрганических, остаточные растворители) Информация, требуемая для синтеза AФИ, может зависеть от того, Имеется ли валидный сертификат CEP? – если да, то информации о синтезе не требуется Описано ли качество рассматриваемого AФИ в монографии официальной фармакопеи? Отсутствие официальной монографии для контроля качества: Требуется детальная информация * TG Dekker – WHO, Ukraine October 2005

2.4.1 Синтез некомпендиальных AФИ 5/50 Струйная диаграмма процесса синтеза В том числе структура и стереохимические параметры исходных материалов и промежуточныхз веществ, реактивов, катализаторов, растворителей Полное описание каждого шага / процесса, в том числе: Условия протекания реакции (контроль времени, температуры, влажности etc.) Количества реактивов/растворителей Мощность производственной линии Очистка промежуточных веществ Метод завершающей очистки API / кристаллизация / растворитель(и) Переработка (процесс должен быть обоснован и валидирован) Контроль процесса Валидация принципиально важных этапов, например, стерильных процедур Рассмотрение (возможного) содержания примесей Органических, остаточных растворителей и катализаторов/неорганических * TG Dekker – WHO, Ukraine October 2005

2.4.2 Спецификации исходных материалов и промежуточных веществ, используемых при синтезе (2.4.1) 5/50 Наличие спецификаций для Исходных материалов и промежуточных веществ (если таковые выделяются) Реактивов, растворителей и катализаторов Растворители Класса 1 использовать не следует (Международная конференция по гармонизации Q3C) Бензол, кальция тетрахлорид, 1,2-дихлорэтан, 1,1-дихлорэтан & 1,1,1-трихлорэтан Наличие заявления об использовании / неиспользовании материалов животного или человеческого происхождения (агенты губчатой энцефаллопатии) Риск передачи возбудителя губчатой энцефалопатии у животных (ВОЗ TRS 908, Приложение 1 or EMEA/410/01 Rev.2) Зачем? Чтобы минимизировать содержание примесей (вопрос безопасности) * TG Dekker – WHO, Ukraine October 2005

2.4.2 Синтез фармакопейных AФИ Наличие Схемы пути синтеза упрощенный линейний график и качественное описание метода производства, в том числе наименования реактивов, растворителей и катализаторов Данные о прохождении завершающих стадий синтеза В том числе процесс очистки В случае подачи действующего CEP Информации не требуется (упрощенный линейний график – по желанию) * TG Dekker – WHO, Ukraine October 2005

2.5 Спецификации AФИ 6/50 2.5.1 AФИ, не описанные в BP, Int.Ph., JP, Ph.Eur., или USP (нефармакопейные AФИ) 2.5.2 API, описанные в BP, Int.Ph., JP, Ph.Eur., или USP (фармакопейные AФИ) Общие замечания AФИ имеет только один набор спецификаций, применимых при выпуске и в ходе повторных исследований FPP имеет два набора спецификаций – относительно выпуска и срока годности * TG Dekker – WHO, Ukraine October 2005

2.5.1 Спецификации: нефармакопейные AФИ ICH Q6A (новые AФИ и препараты) – например: Наличие обоснований для предложенных спецификаций Характеристики и ограничительные факторы очистки Синтез и распад согласно ICH Q3A(R) Растворители в остатке согласно ICH Q3C Аналитические методы и валидация Подготовка и определение/спецификация адекватности первичных и вторичных (рабочих) стандартов, согласно Сертификату анализов CoAs Валидация Сертификата анализов не менее чем на 2 сериях * TG Dekker – WHO, Ukraine October 2005

2.5.1 Спецификации: нефармакопейные AФИ Типичные наборы спецификаций Внешний вид /описание Идентификация (как минимум один способ определения, например инфракрасная фотометрия) Содержание влаги (или пределы обнаружения: влага + остаточные расворители) Примеси Органические вещества, возникающие в процессе синтеза и распада Неидентифицируемые и Общее содержание органических примесей Неорганические примеси, в т ом числе катализаторы Остаточный растворитель(и) Оценка Дополнительные параметры для отдельных AФИ Например, размер частиц, полиморфизм, микробиологические показатели * TG Dekker – WHO, Ukraine October 2005

2.5.2 Спецификации: фармакопейные AФИ Всегда применяется действующая монография Дополнительные необходимые спецификации, не включенные в монографию: размер частиц и полиморфизм Примеси, образующиеся на отдельных стадиях синтеза Спецификации к ним могут быть довнесены в монографию Остаточные растворители (специфичные для каждой стадии) Наличие действующих сертификатов анализа не менее чем для двух серий CEP обычно содержит указания на проведение дополнительных к содержащимся в монографии исследований В том числе, остаточных растворителей примесей * TG Dekker – WHO, Ukraine October 2005

2.7 Исследования стабильности 8/50 2.7.1 Исследования AФИ в экстремальных условиях (ускоренный распад) помогают: определить возможные метаболиты и пути их образования установить стабильность молекулы подтвердить специфичность метода оценки стабильности Диодно-матричное определение пикового уровня очистки API! 2.7.2 Испытания стабильности (требуется законом) для предоставления доказательных данных: Каким образом качество AФИ изменяется во времени Под влиянием различных внешних факторов - в т.ч. температуры, влажности, света; и установления протяженности дополнительных исследований AФИ Выработки рекомендаций относительно условий складского хранения ICH Q1A(R2) * TG Dekker – WHO, Ukraine October 2005

2.7.1 Исследования в экстремальных условиях (ускоренный распад) 8/50 Примерные условия для экстремальных реакций Условия должны частично (на 10-30%) разлагать AФИ на продукты первичного распада Условия можно менять, с тем чтобы достичь требуемого уровня распада ** Температура не должна приближаться к точке плавления более чем на 10°C Стрессовый фактор Условие (пример) Влажность ≥ 75% RH (тв.) Нагрев ** ≥ 60°C (тв.) Нагрев вода Кислота 0.1 M HCl Щелочь 0.1 M NaOH Окисление 3% H2O2 Свет ICH Q1B Ионы металлов (выборочно) 0.05 M Fe2+ or Cu2+ * TG Dekker – WHO, Ukraine October 2005

2.7.1 Исследования в экстремальных условиях (ускоренный распад). Научная литература Данные научной литературы и/или CEP в поддержку «и/или» с целью восполнения недостающих экспериментальных данных Примеры данных научной литературы Rifampicin (предыдущие слайды) Окисление, гидролиз Indinavir sulfate (предыдущие слайды) Интрамолекулярные реакции – нагрев, влажность, кислота, щелочь Efavirenz (следующий слайд) Гидролиз – pH-зависимый * TG Dekker – WHO, Ukraine October 2005
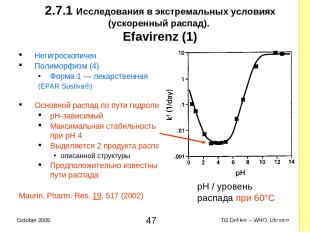
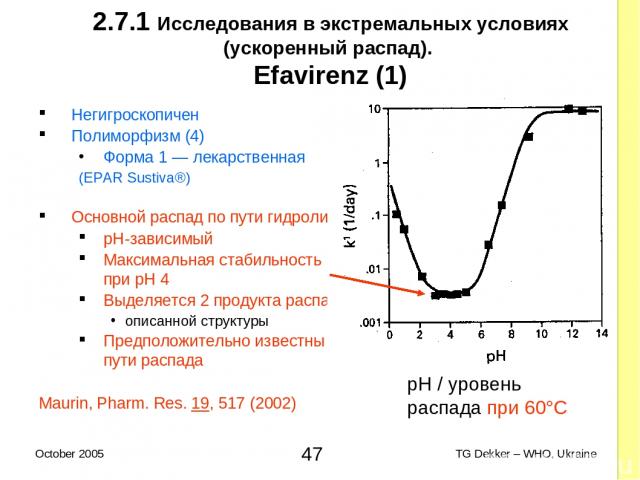
2.7.1 Исследования в экстремальных условиях (ускоренный распад). Efavirenz (1) Негигроскопичен Полиморфизм (4) Форма 1 — лекарственная (EPAR Sustiva®) Основной распад по пути гидролиза pH-зависимый Максимальная стабильность при pH 4 Выделяется 2 продукта распада описанной структуры Предположительно известны пути распада Maurin, Pharm. Res. 19, 517 (2002) pH / уровень распада при 60°C * TG Dekker – WHO, Ukraine October 2005
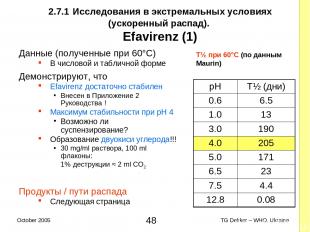
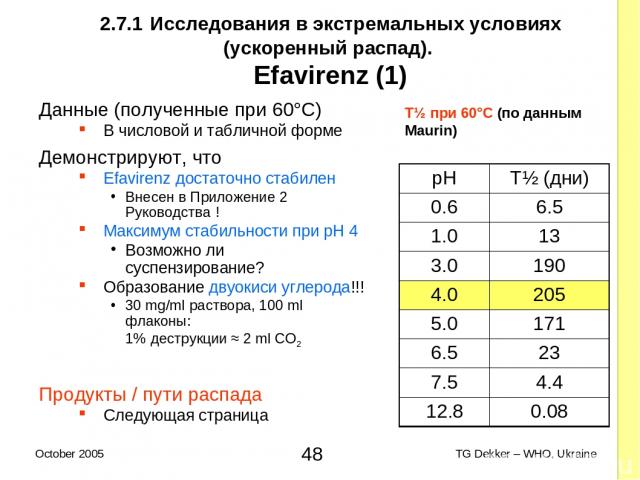
2.7.1 Исследования в экстремальных условиях (ускоренный распад). Efavirenz (1) Данные (полученные при 60°C) В числовой и табличной форме Демонстрируют, что Efavirenz достаточно стабилен Внесен в Приложение 2 Руководства ! Максимум стабильности при pH 4 Возможно ли суспензирование? Образование двуокиси углерода!!! 30 mg/ml раствора, 100 ml флаконы: 1% деструкции ≈ 2 ml CO2 Продукты / пути распада Следующая страница T½ при 60°C (по данным Maurin) pH T½ (дни) 0.6 6.5 1.0 13 3.0 190 4.0 205 5.0 171 6.5 23 7.5 4.4 12.8 0.08 * TG Dekker – WHO, Ukraine October 2005
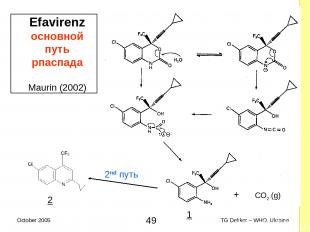
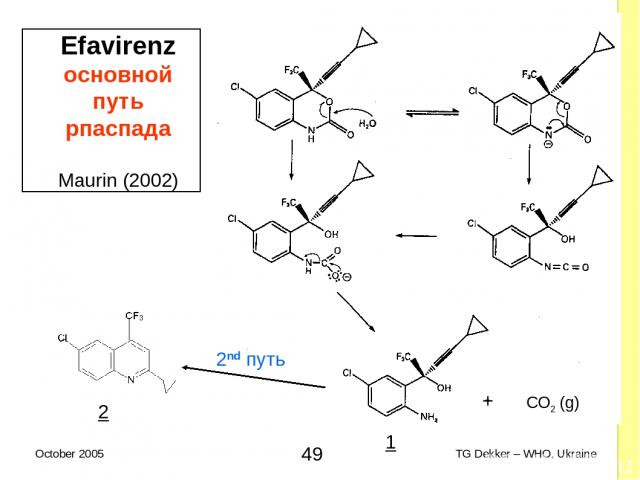
Efavirenz основной путь рпаспада Maurin (2002) 2nd путь 1 2 + CO2 (g) * TG Dekker – WHO, Ukraine October 2005

Некоторые итоги Подаваемые данные должны демонстрировать, что AФИ пригоден для использования при производстве ГЛС с точки зрения безопасности, эффективности и качества Важные моменты: AФИ должен соответствовать требуемой структуре и стереохимическим параметрам Должны быть хорошо изучены его физические свойства, в частности гигроскопичность, свойства кристаллов и растворимость Процесс синтеза должен выполняться согласно требованиям GMP, чтобы Единообразно производить AФИ требуемых химических и физических свойств Ограничить содержание примесей в соответствии с принятыми стандартами Набор спецификаций должен состоять из валидированных аналитических методик удовлетворять надлежащим критериям приемлемости, которым должен соответствовать AФИ, чтобы рассматриваться как пригодный для использования по назначению на протяжении периода повторных испытаний в предложенной упаковке * TG Dekker – WHO, Ukraine October 2005






![Литературные источники Узнайте о своем AФИ,используя: Руководства / серии / книги – в том числе: (Аналитические) Параметры лекарственных субстанций и вспомогательных веществ — [eds: Florey / Brittain – 31 том] The Merck Index (по структуре, свойства… Литературные источники Узнайте о своем AФИ,используя: Руководства / серии / книги – в том числе: (Аналитические) Параметры лекарственных субстанций и вспомогательных веществ — [eds: Florey / Brittain – 31 том] The Merck Index (по структуре, свойства…](https://fs3.ppt4web.ru/images/132073/179096/640/img5.jpg)