Презентация на тему: Железо – элемент побочной подгруппы

Железо – элемент побочной подгруппы

Общая характеристика железа 1Нахождение в природе.2Положение в ПСХЭ. Строение атома.3Физические свойства. 4Химические свойства.5Получение.6Применение.

Нахождение в природе Fe ХАЛЬКОПИРИТ ЧЁРНЫЙ ПИРИТ ПИРИТ
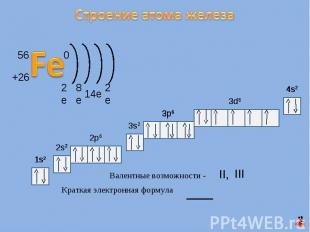
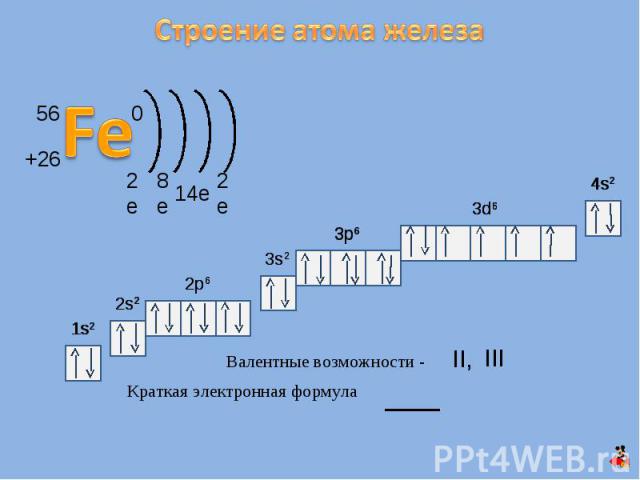
Строение атома железа Валентные возможности - Краткая электронная формула

Железо – простое вещество Железо - сравнительно мягкий ковкий серебристо-серый металл.Температура плавления – 1535 0СТемпература кипения около 2800 0СПри температуре ниже 770 0С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит).Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается».
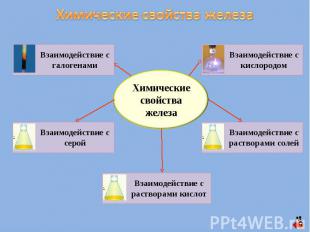
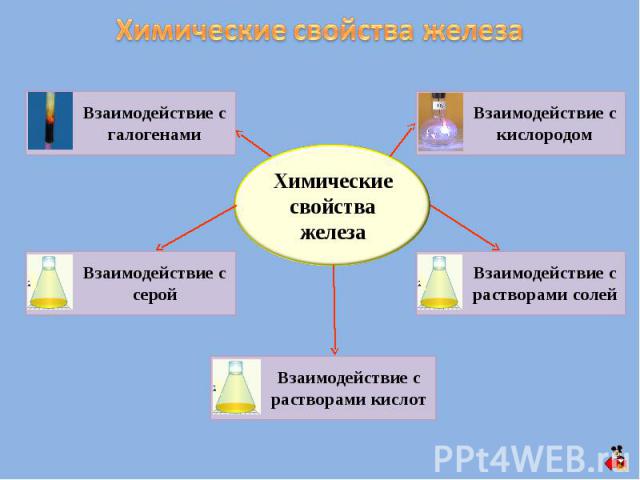
Химические свойства железа Взаимодействие с галогенами Взаимодействие с серой Взаимодействие с растворами кислот Взаимодействие с растворами солей Взаимодействие с кислородом Химические свойства железа

Получение железа Восстановление из оксидов железа:Алюмотермия: 2Al + Fe2O3 = 2Fe + Al2O3Водородом: 2Н2 + Fe3O4 = 3Fe + 4H2O

Когда открыто железо никто не знает и не узнает, так как это было слишком давно. Но пользуются железом до сих пор, и в настоящее время железо не заменимо в промышленности и труде.

Закончите уравнения реакций: Fe + HBr = Fe + HCl(р-р) = Fe + O2 = Fe + Br2 = Fe + H2SO4(р-р) = Fe + Co(NO3)2 = Fe + H2SO4(конц.) =

Домашнее задание § 14 (до соединений железа), упр. 2