Презентация на тему: Кремний, его физические и химические свойства

Кремний, его физические и химические свойства

Цели урока:- рассмотреть положение кремния в периодической системе Д.И.Менделеева и строении его атома;- рассмотреть нахождение кремния в природе;- обратить внимание на физические свойства кремния;- рассмотреть химические свойства кремния и способы его получения.
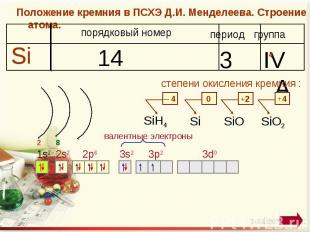
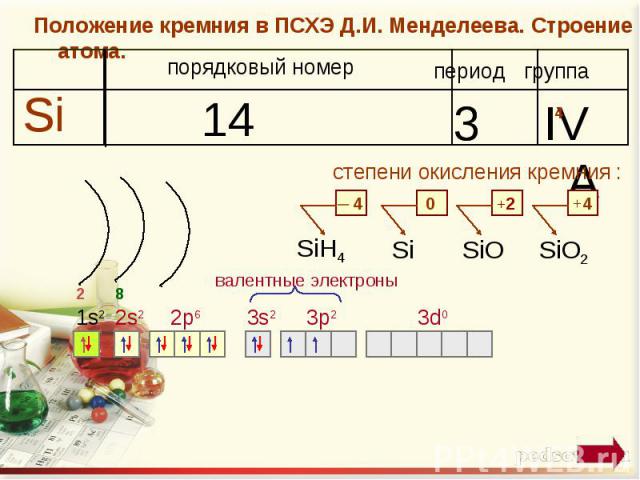
Положение кремния в ПСХЭ Д.И. Менделеева. Строение атома. степени окисления кремния : валентные электроны


Способы полученияЛабораторный способ получения:Si+4O2 + 2Mg0 → 2Mg+2O + Si0Промышленный способ получения: 19000CSi+4O2 + 2C0 ―――→ 2C+2O + Si0

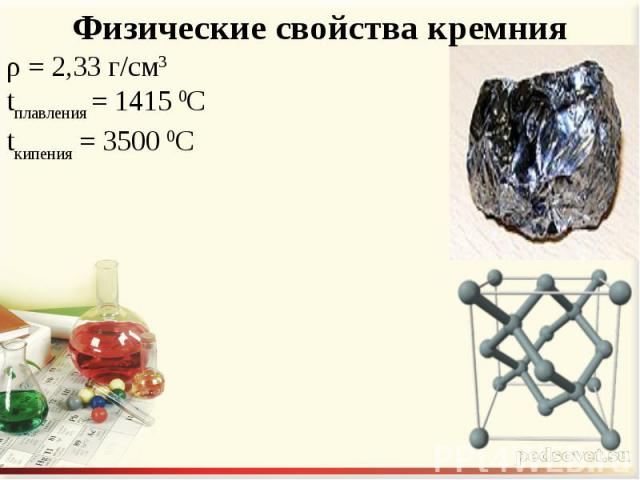
Физические свойства кремния ρ = 2,33 г/см3tплавления = 1415 0Сtкипения = 3500 0С

Химические свойства 1) Кремний – восстановительВсе реакции протекают при нагревании.а) взаимодействие с кислородомSi0 + O20 = Si+4O2–2Si0 -4e → Si+4 │4│1-восстановительO20 + 4e → 2O –2 │4│1-окислительб) взаимодействие с хлором Si0 + 2Cl20 = Si+4Cl4-1 Si0 -4e → Si+4 │4 │1-восстановитель Cl20 +2e → 2Cl- │2 │ 2-окислитель

в) взаимодействие с серойSi0 + 2S0 → Si+4S2-2Si0 -4ē → Si+4 │2│1-восстановительS0 +2ē → S-2 │4│2-окислительг) взаимодействие с углеродом 20000С Si0 + С0 ―――→ Si+4С-4 (карборунд) Si0 -4e → Si + 4 │4│ 1-восстановитель С0 +4e → С -4 │4│ 1-окислитель

д) взаимодействие с водяным паромSi0 + H2+1O (пар) → Si+4O2 + H20↑Si0 -4e → Si + 4│2│1-восстановитель2H+ +2e → H20│4│2-окислителье) взаимодействие со щелочью Si0 + 2NaOH + H+2O → Na2Si+4O3 + 2H20↑ Si0 -4e → Si+4 │4│1-восстановитель 2H+ +2e → H20 │2│2-окислитель

2) Кремний – окислительВзаимодействие с металламиSi0 + 2Mg0 = Mg2+2Si–4 (силицид магния)Si0 +4e → Si – 4 │2 │1-окислительMg0 -2e → Mg +2│4 │2-восстановительКремний напрямую не соединяется с водородом. Силан получают косвенно, действуя на силициды металлов водой или кислотами Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑

Домашнее задание §31, прочитать; конспект урока выучить, упр.1, 4, 5 после параграфа