Презентация на тему: Законы электролиза

Тема урока: «Законы электролиза»

Задачи урока: 1. Обучающие: обеспечить усвоение предметного содержания темы «Законы электролиза»: - на первом уровне отличать электролиты от других видов веществ по электропроводности; - на втором уровне формировать понятие электролитов и их практического применения; - на третьем уровне сравнивать, анализировать, формировать их физические свойства; - на четвертом уровне оперировать понятиями темы, применять практические знания для объяснения закона Фарадея; - на пятом уровне осознанно использовать полученные знания.

Задачи урока: 2. Развивающая. Развитие основных способов мыслительной деятельности (сравнение, сопоставление, анализ, обобщение). Развивать память, познавательные интересы, самостоятельность в организации труда с персональным компьютером. Оценить результаты своей работы.

Задачи урока: 3. Воспитательная. Способствовать формированию коммуникативных качеств, трудолюбия, ответственности за порученное дело.

Методическая цель. Показать эффективность использования элементов технологии критического мышления.

Тип урока Комбинированный урок (использование элементов технологии критического мышления)

Изучать, открывать, удивлять, Верить в силу наук для людей И природы закон применять, Как его применял Фарадей.

Фаза вызова
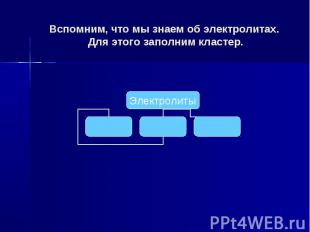
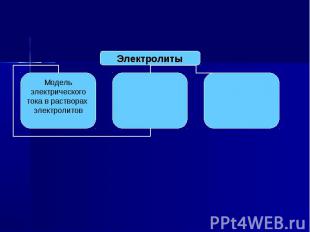
Вспомним, что мы знаем об электролитах. Для этого заполним кластер.

Проверим ваши знания. Для этого проведем физический диктант

Электролиты – это Электролиты – это

Ответ правильный. Вы получаете 1 балл.

Ответ неправильный. Ответ неправильный. Правильный ответ: Электролиты – это растворы неорганических солей, кислот, щелочей. Вы получаете 0 баллов.


Ответ правильный. Вы получаете 1 балл.

Ответ неправильный. Ответ неправильный. Правильный ответ: Носителями зарядов в электролитах являются положительные и отрицательные ионы, которые образуются вследствие электролитической диссоциации. Вы получаете 0 баллов.


Ответ правильный. Вы получаете 1 балл.

Ответ неправильный. Ответ неправильный. Правильный ответ: Электролитическая диссоциация - это распад молекул электролитов на ионы. Вы получаете 0 баллов.


Ответ правильный. Вы получаете 1 балл.

Ответ неправильный. Ответ неправильный. Правильный ответ: Рекомбинация - это процесс, противоположный диссоциации. Вы получаете 0 баллов.


Ответ правильный. Вы получаете 1 балл.

Ответ неправильный. Ответ неправильный. Правильный ответ: Электролиз - это окислительно-восстановительная реакция, протекающая на электродах при прохождении электрического тока через электролит. Вы получаете 0 баллов.


Ответ правильный. Вы получаете 1 балл.

Ответ неправильный. Ответ неправильный. Правильный ответ: Окислительно-восстановительная реакция - это реакция с изменением степени окисления элементов. Вы получаете 0 баллов.


Ответ правильный. Вы получаете 1 балл.

Ответ неправильный. Ответ неправильный. Правильный ответ: Проводимость электролитов называют ионной. Вы получаете 0 баллов.


Ответ правильный. Вы получаете 1 балл.

Ответ неправильный. Ответ неправильный. Правильный ответ: Катод – это электрод, соединенный с отрицательным полюсом источника тока. Вы получаете 0 баллов.


Ответ правильный. Вы получаете 1 балл.

Ответ неправильный. Ответ неправильный. Правильный ответ: Анод – это электрод, соединенный с положительным полюсом источника тока. Вы получаете 0 баллов.


Ответ правильный. Вы получаете 1 балл.

Ответ неправильный. Ответ неправильный. Правильный ответ: Электролиз применяют для получения металлов (меди, алюминия) электролитическим способом, в гальванопластике и др. Вы получаете 0 баллов.

Посчитайте свои баллы и сообщите учителю.

Итог по фазе вызова. «Фишбон»

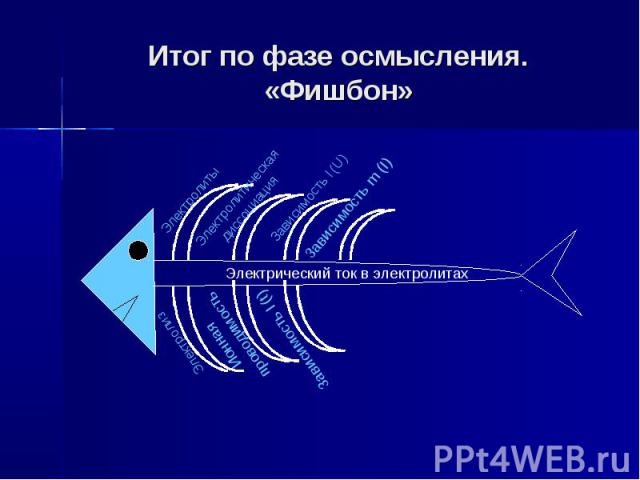
Фаза осмысления Продолжаем нашу работу. Следующая фаза осмысления. Попробуем установить основные закономерности протекания электрического тока в растворах электролитов.

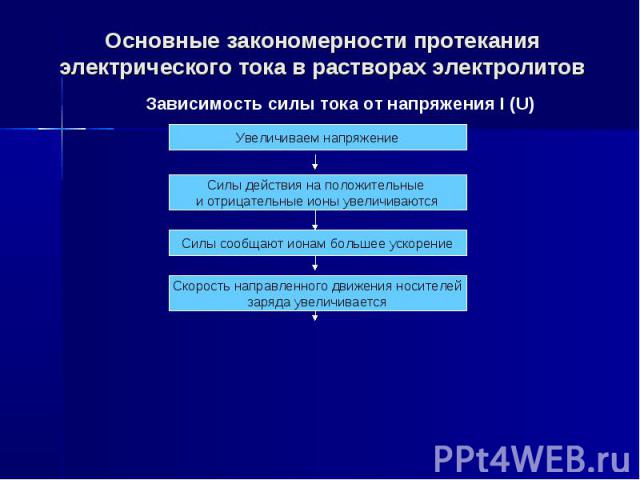
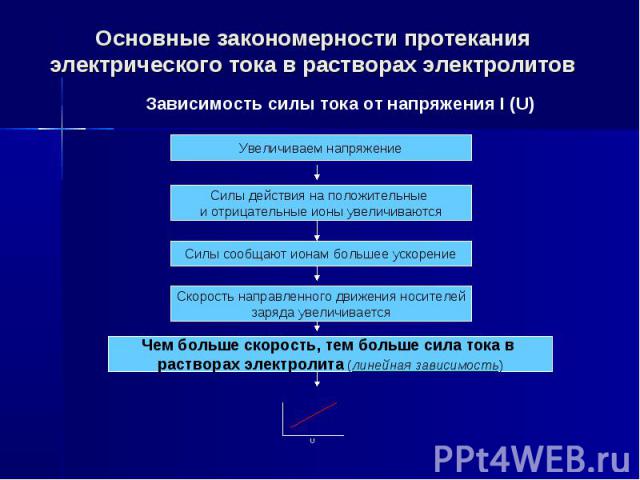
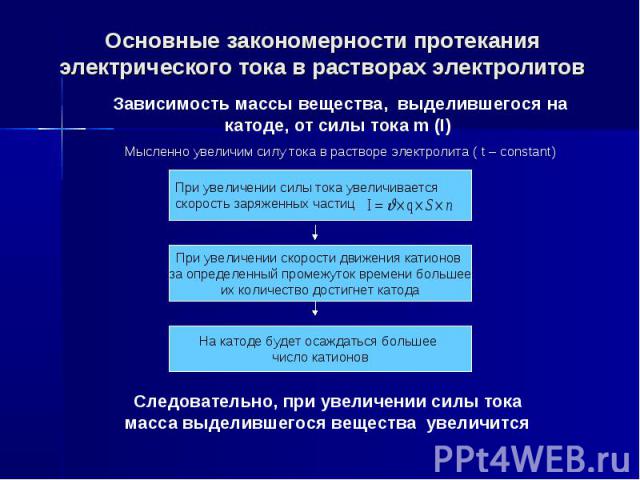
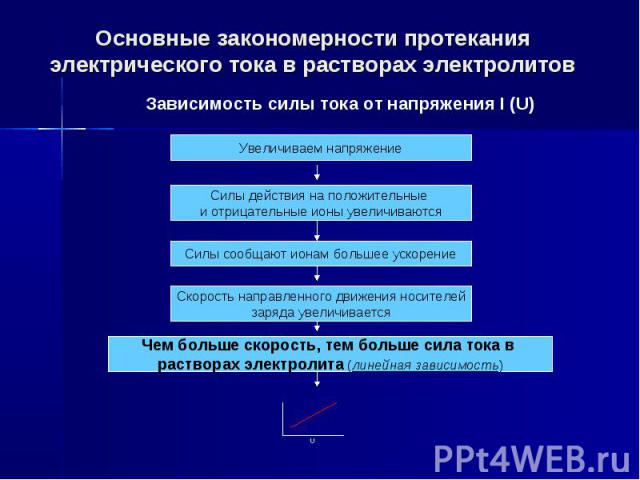
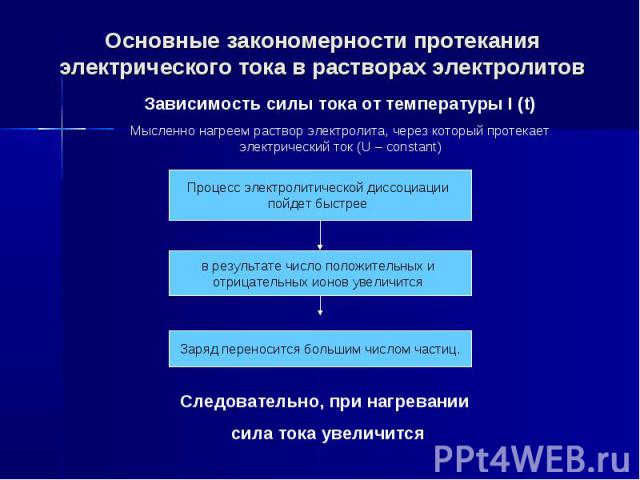
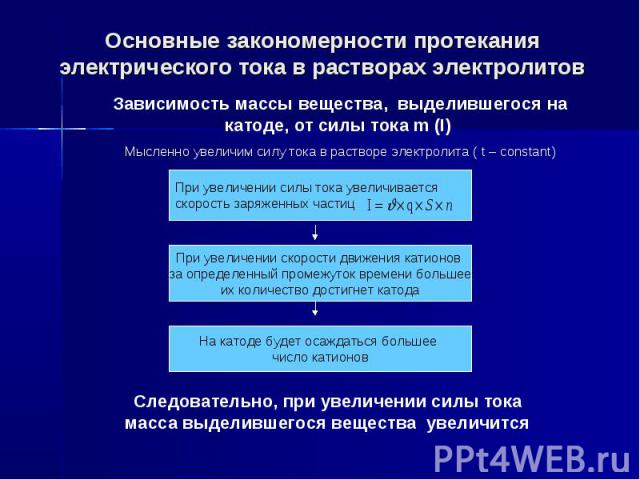
Основные закономерности протекания электрического тока в растворах электролитов

Основные закономерности протекания электрического тока в растворах электролитов

Основные закономерности протекания электрического тока в растворах электролитов
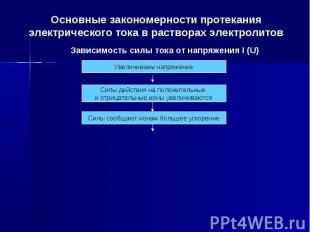
Основные закономерности протекания электрического тока в растворах электролитов
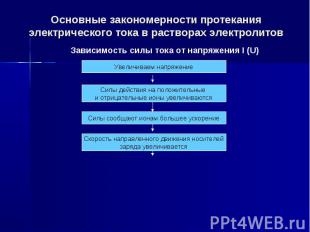
Основные закономерности протекания электрического тока в растворах электролитов
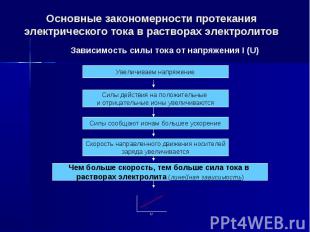
Основные закономерности протекания электрического тока в растворах электролитов

Основные закономерности протекания электрического тока в растворах электролитов

Основные закономерности протекания электрического тока в растворах электролитов
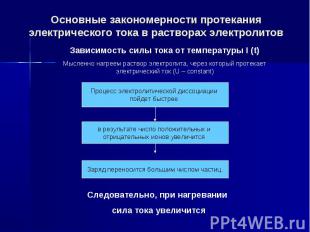
Основные закономерности протекания электрического тока в растворах электролитов

Основные закономерности протекания электрического тока в растворах электролитов

Основные закономерности протекания электрического тока в растворах электролитов

Основные закономерности протекания электрического тока в растворах электролитов

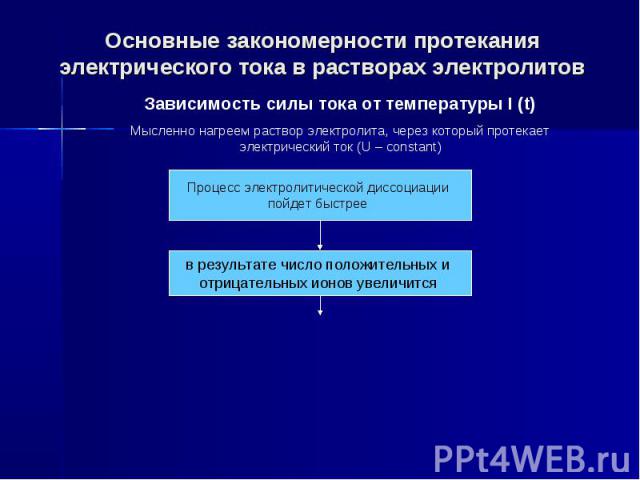
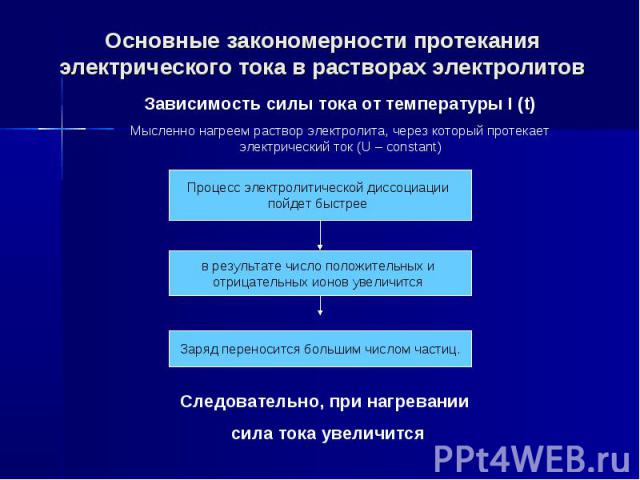
Повторим основные закономерности протекания электрического тока в растворах электролитов. Повторим основные закономерности протекания электрического тока в растворах электролитов.
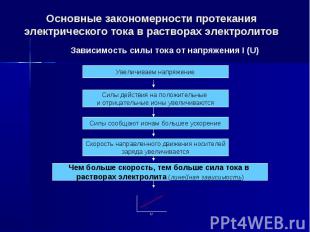
Основные закономерности протекания электрического тока в растворах электролитов
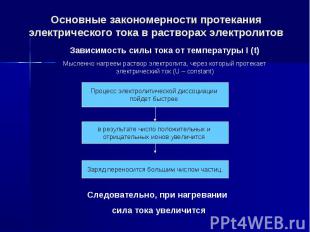
Основные закономерности протекания электрического тока в растворах электролитов

Основные закономерности протекания электрического тока в растворах электролитов

Итог по фазе осмысления. «Фишбон»

Фаза осмысления (продолжение) Зная механизм проводимости электролитов можно определить массу вещества, выделившегося при электролизе. Чтобы решить эту задачу, необходимо получить и изучить законы Фарадея.

Самостоятельная работа с учебником I закон Фарадея. Алгоритм.

1. Запишите формулу массы вещества

2. Свяжите массу атома с молярной массой.

3. Находим N – число ионов, проходящих через раствор электролитов. а) Каждый одновалентный ион несет заряд, равный заряду электрона e. Если валентность равна n, кратный ему заряд равен ne.

3. Находим N – число ионов, проходящих через раствор электролитов. г) так как в выражении (2) правой части все физические величины, кроме q, постоянны, формулу (2) записываем

4. Электрохимический эквивалент

Самостоятельная работа с учебником II закон Фарадея. Алгоритм.

1. Дайте определение химического эквивалента. Химический эквивалент - это отношение атомной (А) массы вещества к его валентности (n)

2. Запишите второй закон Фарадея. Второй закон Фарадея: электрохимический эквивалент пропорционален химическому эквиваленту данного вещества.

3. Дайте определение постоянной Фарадея. Постоянная Фарадея F – численно равна заряду, который должен пройти через электролит для выделения на электроде количества вещества, равного его химическому эквиваленту.

Итог по фазе осмысления. «Фишбон»

Фаза практического осмысления (работа с дополнительной литературой) Законы Фарадея нашли практическое применение в науке и технике, в частности для определения заряда одновалентного иона.

Мозговая атака (мысли по кругу) Как решать задачи, используя законы электролиза (памятка).

Мозговая атака (мысли по кругу) Последовательность решения задач.

Фаза практического осмысления (работа с дополнительной литературой) Применение законов Фарадея при решении качественных и количественных задач.

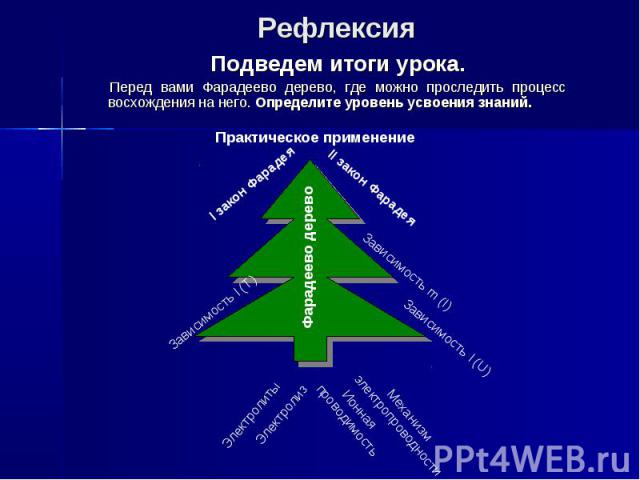
Рефлексия Подведем итоги урока. Перед вами Фарадеево дерево, где можно проследить процесс восхождения на него. Определите уровень усвоения знаний.

Рефлексия Подведем итоги урока.

Рефлексия Подведем итоги урока.

Рефлексия Подведем итоги урока.

Рефлексия Подведем итоги урока.

Рефлексия Подведем итоги урока.