Презентация на тему: Основы органической химии

Лекция № 5 Основы органической химии

Общая характеристика органических соединений Органические соединения являются производными углерода; Углерод в органических соединениях образует четыре ковалентные связи; Кроме углерода в органические соединения входят атомы водорода; Простейшие органические соединения – углеводороды;

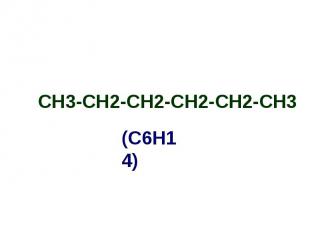
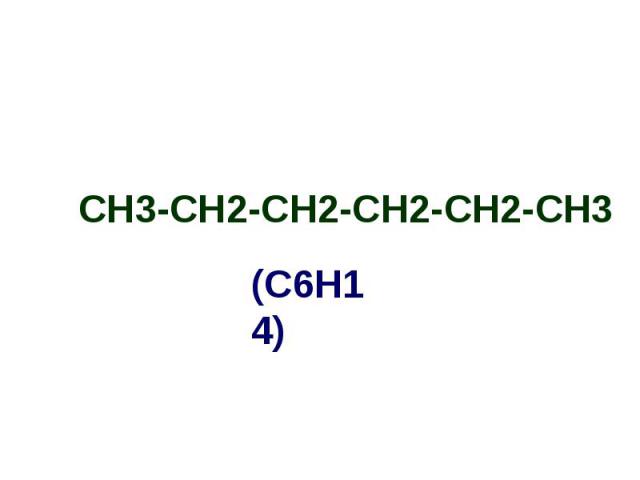
СН3-СН2-СН2-СН2-СН2-СН3 СН3-СН2-СН2-СН2-СН2-СН3
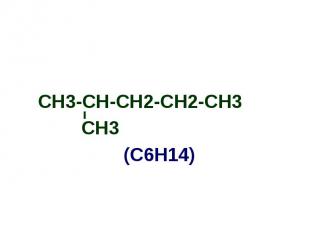
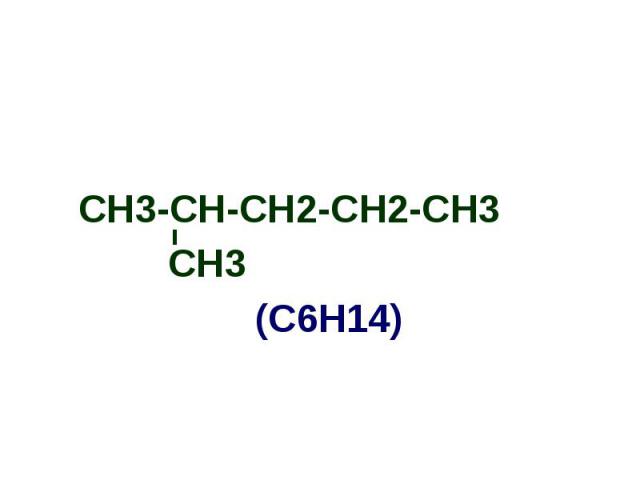
СН3-СН-СН2-СН2-СН3 СН3-СН-СН2-СН2-СН3 СН3 (С6Н14)
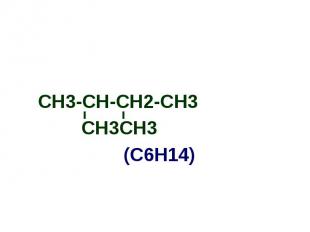
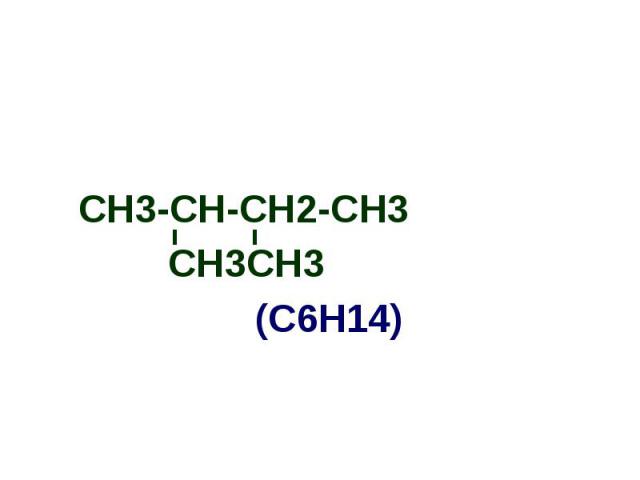
СН3-СН-СН2-СН3 СН3-СН-СН2-СН3 СН3СН3 (С6Н14)
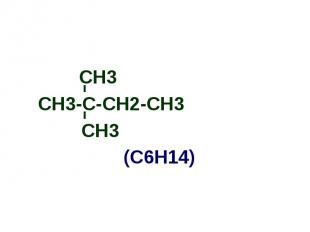
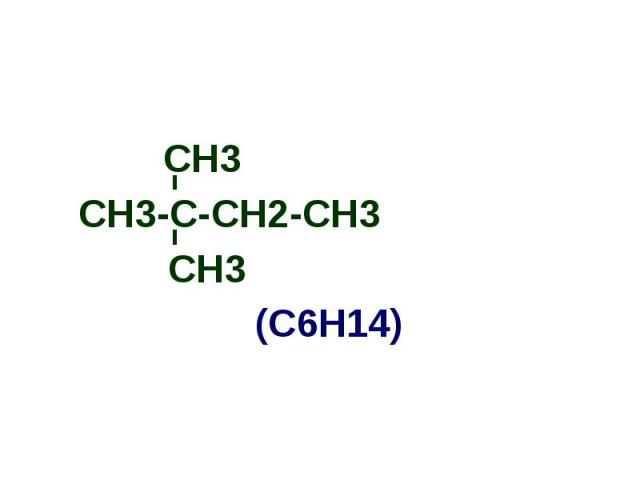
СН3-С-СН2-СН3 СН3-С-СН2-СН3 СН3 (С6Н14)

Углеводороды В зависимости от наличия или отсутствия двойных и тройных связей углеводороды делятся на предельные или насыщенные, не имеющие двойных и тройных связей (алканы), и непредельные или ненасыщенные, содержащие двойные связи (алкены) или тройные связи (алкины).

Алканы Простейшим алканом является метан - СН4; Имея общую формулу - СnH2n+2, алканы образуют ряд соединений с однотипным строением и сходными химическими свойствами; Такой ряд называется гомологическим, а члены этого ряда гомологами: СН4 С2Н6 С3Н8 С4Н10 С5Н12 С6Н14 С7Н16 метан этан пропан

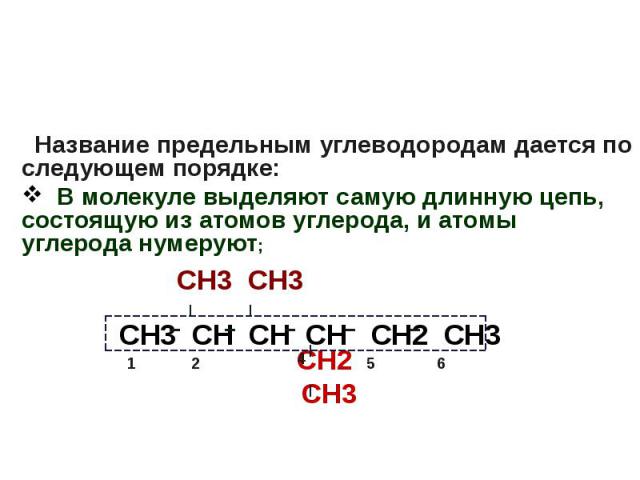
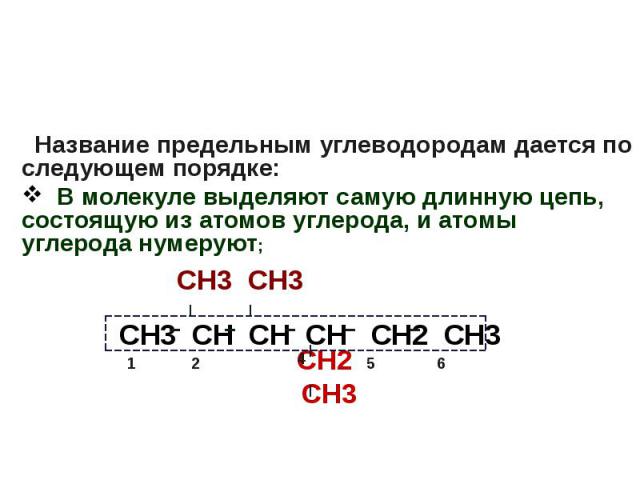
Международная номенклатура органических соединений Название предельным углеводородам дается по следующем порядке: В молекуле выделяют самую длинную цепь, состоящую из атомов углерода, и атомы углерода нумеруют; СН3 СН3 СН2 СН3
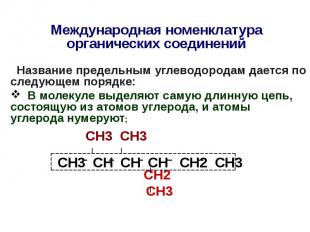
Международная номенклатура органических соединений Название предельным углеводородам дается по следующем порядке: В молекуле выделяют самую длинную цепь, состоящую из атомов углерода, и атомы углерода нумеруют; СН3 СН3 СН2 СН3
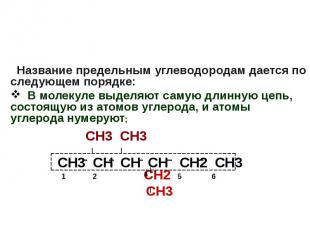
Название предельным углеводородам дается по следующем порядке: В молекуле выделяют самую длинную цепь, состоящую из атомов углерода, и атомы углерода нумеруют; СН3 СН3 СН2 СН3
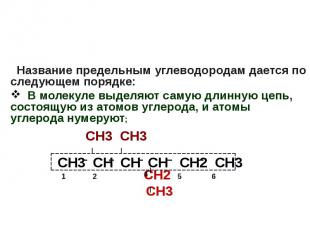
Название предельным углеводородам дается по следующем порядке: В молекуле выделяют самую длинную цепь, состоящую из атомов углерода, и атомы углерода нумеруют; СН3 СН3 СН2 СН3
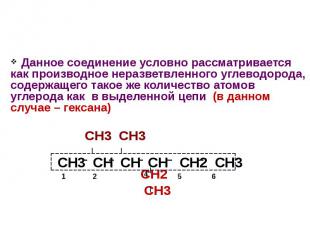
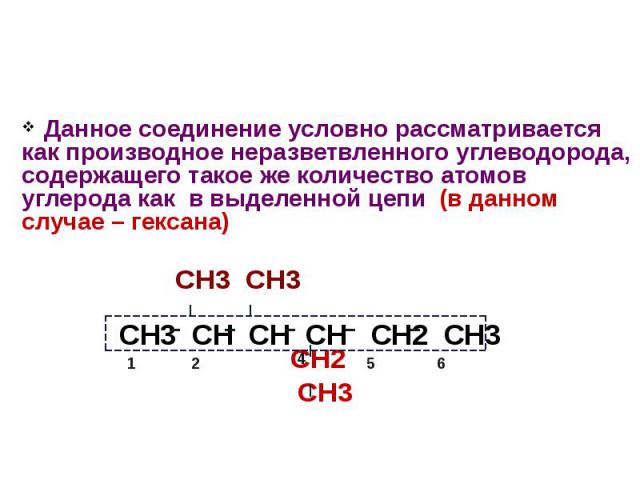
Данное соединение условно рассматривается как производное неразветвленного углеводорода, содержащего такое же количество атомов углерода как в выделенной цепи (в данном случае – гексана) СН3 СН3 СН2 СН3

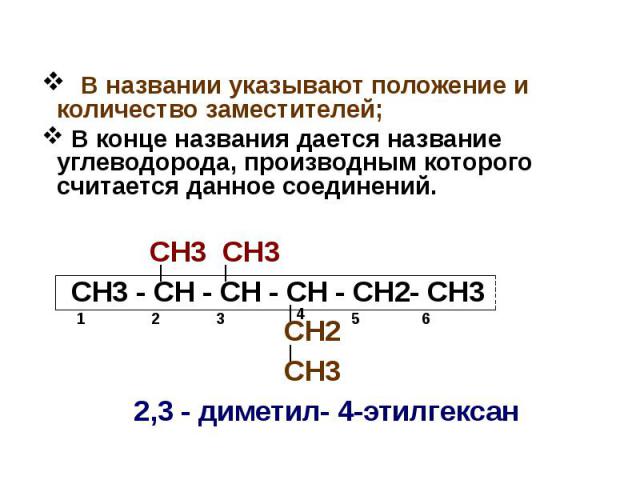
СН3 СН3 СН3 - СН - СН - СН - СН2- СН3 СН2 СН3 2,3 - диметил- 4-этилгексан

Физико-химические свойства алканов Все алканы не растворимы в воде; Алканы, содержащие не более 5 углеродных атомов, являются газами (метан, этан, пропан, бутан, пептан); Алканы, содержащие от 6 до 15 углеродов, - жидкости (гексан, гептан, октан, нонан, декан); Алканы, содержащие более 15 углеродных атомов, находятся в твердом состоянии (парафины)

Химические свойства Реакция окисления: СН4 + 2О2 2Н2О + СО2 + Q (тепло) Реакция замещения: СН4 + Сl2 CH3Cl + HCl CH3Cl + Сl2 CH2Cl2 + HCl CH2Cl2 + Сl2 CHCl3 + HCl CHCl3 + Сl2 CCl4 + HCl

Непредельные углеводороды Физико-химические свойства Такие же как и у предельных углеводородов; Химические свойства Реакция окисления: С2Н4 + 3О2 2Н2О + 2СО2 + Q (тепло)
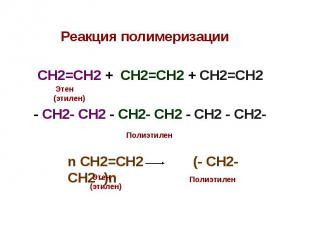
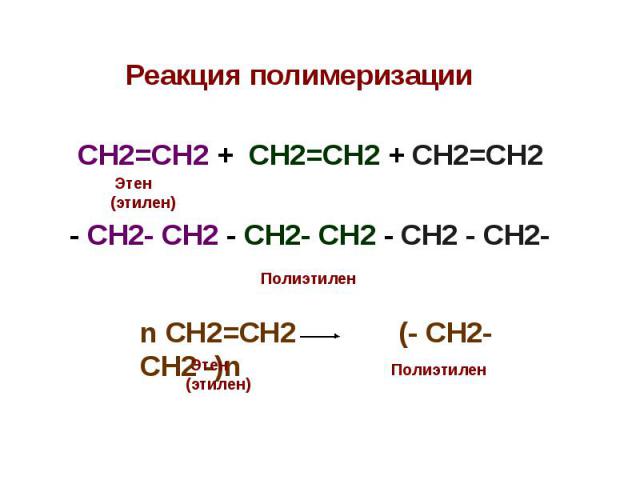
Реакция полимеризации Реакция полимеризации СН2=СН2 + СН2=СН2 + СН2=СН2 - СН2- СН2 - СН2- СН2 - СН2 - СН2-

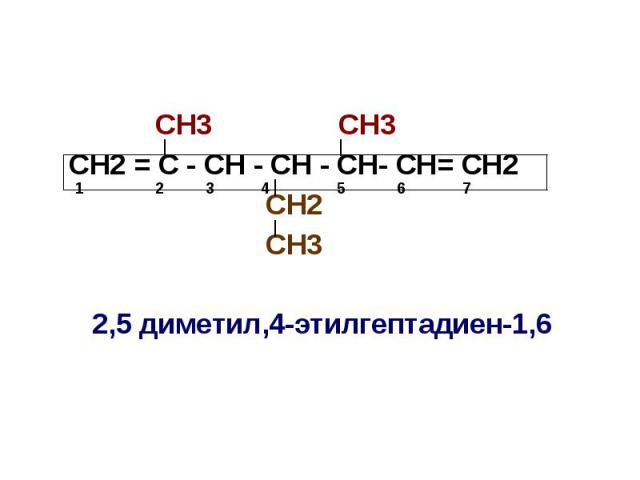
Номенклатура непредельных углеводов За основу названия берется название соответствующего предельного углеводорода, и в этом названии вместо окончания «ан» ставятся окончания «ен» у алкенов и «ин» у алкинов; Если имеется более одной двойной или тройной связи, перед окончанием «ен» или «ин» ставится числительное, указывающее на количество двойных или тройных связей: Положение в молекуле двойной или тройной связи указывается цифрой, показывающей между какими атомами углерода находится двойная или тройная связь, причем указывается только атом углерода с меньшим номером
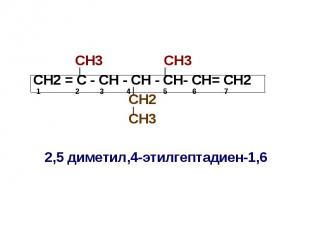
СН3 СН3 СН2 = С - СН - СН - СН- СН= СН2 СН2 СН3 2,5 диметил,4-этилгептадиен-1,6

Спирты Общая формула спиртов: R-(OH)n Классификация спиртов: В зависимости от количества спиртовых групп спирты делятся на одноатомные, двухатомные, трехатомные и многоатомные (содержат более трех спиртовых групп) СН3ОН метанол СН2-ОН СН2-ОН СН2-ОН этандиол СН -ОН глицерин СН2-ОН

Физико-химические свойства спиртов Низкомолекулярные спирты, содержащие не более 11-12 атомов углерода, являются жидкостями; Высокомолекулярные спирты, содержащие более 12 атомов углерода, находятся твердом состоянии; Низкомолекулярные спирты обычно растворимы в воде; Высокомолекулярные спирты в воде не растворимы.
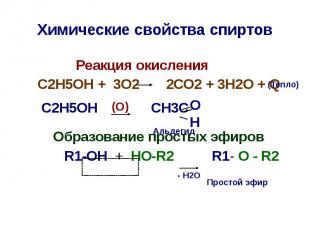
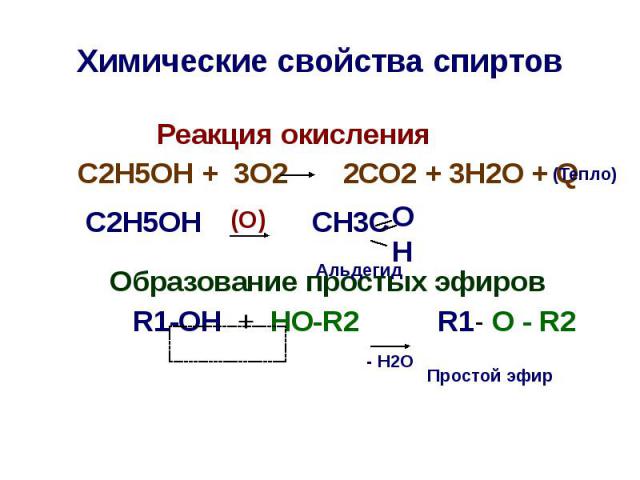
Химические свойства спиртов Реакция окисления С2Н5ОН + 3О2 2СО2 + 3Н2О + Q С2Н5ОН CH3C Образование простых эфиров R1-OH + HO-R2 R1- O - R2

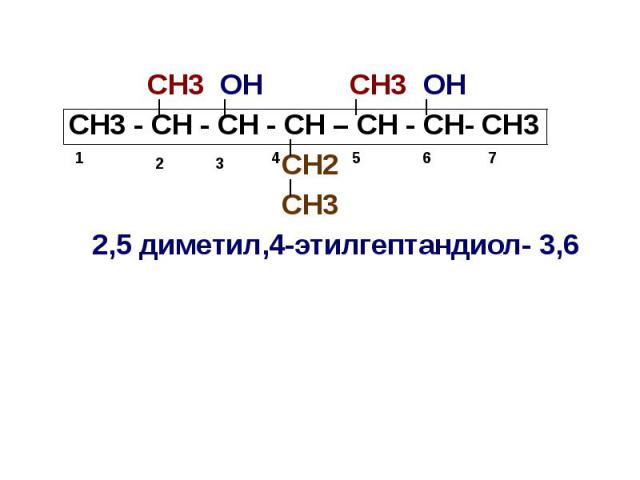
Номенклатура спиртов За основу названия берется название углеводорода, входящего в молекулу спирта, и добавляется окончание «ол» Если имеется более одной спиртовой группы, перед окончанием «ол» ставится числительное, указывающее на количество спиртовых групп, после которого цифрой обозначается положение спиртовых групп в молекуле:
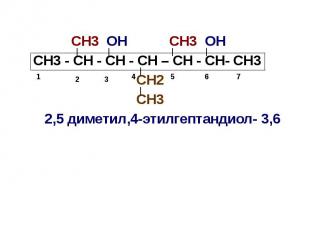
СН3 ОН СН3 ОН СН3 - СН - СН - СН – СН - СН- СН3 СН2 СН3 2,5 диметил,4-этилгептандиол- 3,6
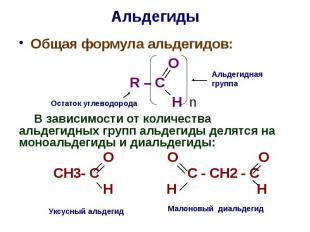
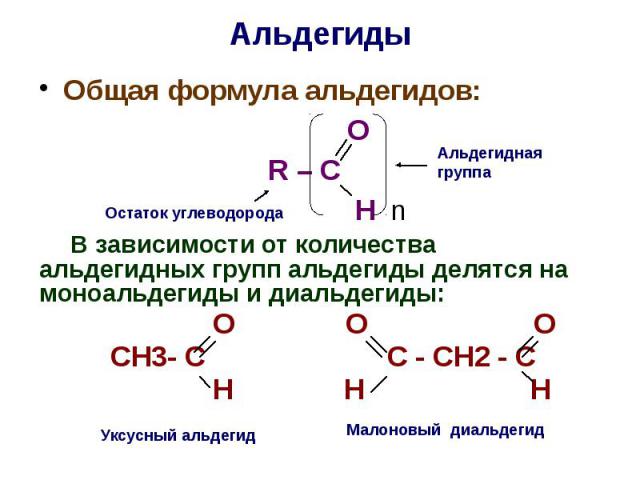
Альдегиды Общая формула альдегидов: O R – C H n В зависимости от количества альдегидных групп альдегиды делятся на моноальдегиды и диальдегиды: О О О СН3- С С - СН2 - С Н Н Н
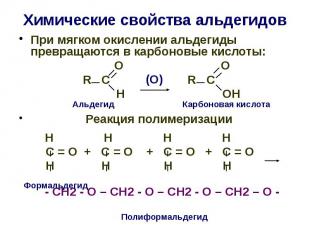
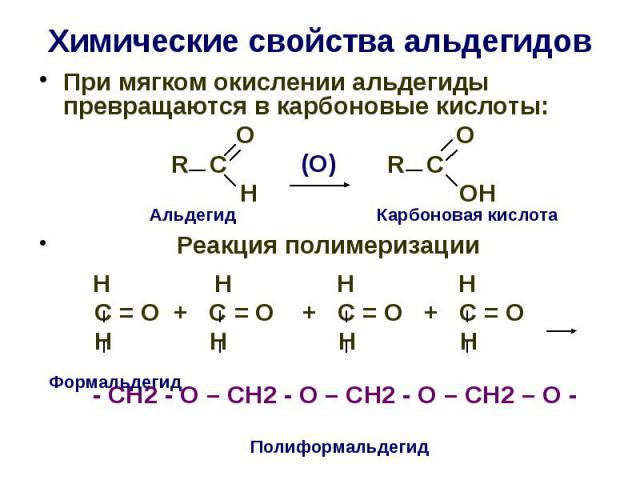
Химические свойства альдегидов При мягком окислении альдегиды превращаются в карбоновые кислоты: О О R C R C H OH Реакция полимеризации Н Н Н Н С = О + С = О + С = О + С = О Н Н Н Н - СН2 - О – СН2 - О – СН2 - О – СН2 – О -

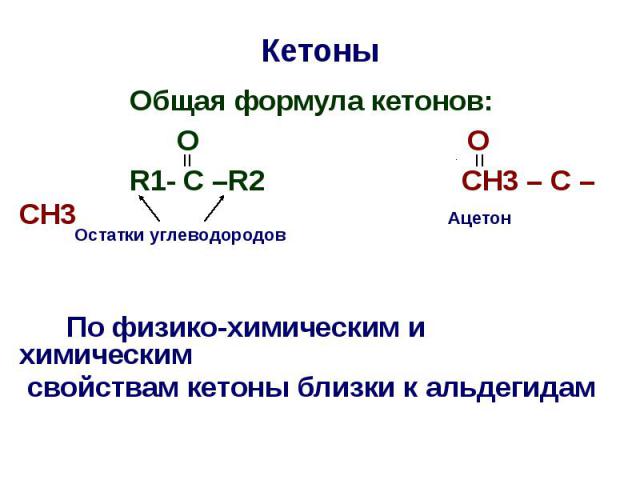
Кетоны Oбщая формула кетонов: O O R1- C –R2 CH3 – C – CH3 По физико-химическим и химическим свойствам кетоны близки к альдегидам
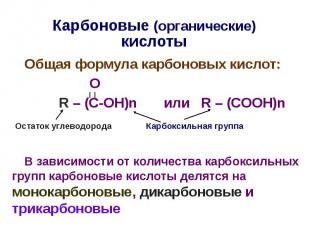
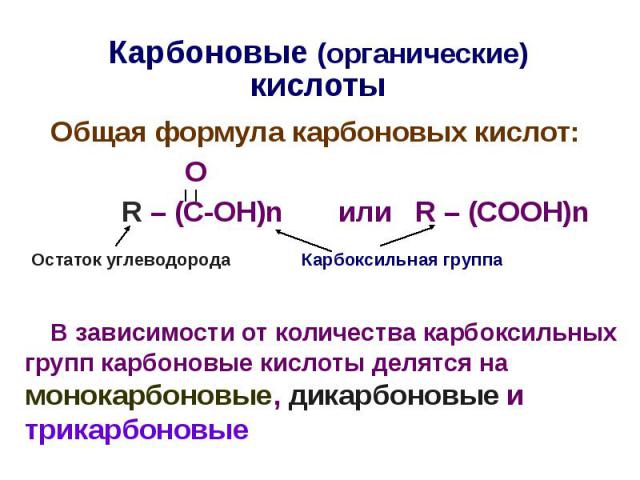
Карбоновые (органические) кислоты Общая формула карбоновых кислот: О R – (C-OH)n или R – (COOH)n В зависимости от количества карбоксильных групп карбоновые кислоты делятся на монокарбоновые, дикарбоновые и трикарбоновые

CH3 COOH COOH CH3 COOH COOH COOH CH2 CH2 CH2 HO- C- COOH COOH CH2 COOH В зависимости от размера углеводородного радикала карбоновые кислоты делятся на низшие (в радикал входит не более 10 атомов углерода) и высшие (в радикале содержится более 10 углеродных атомов).
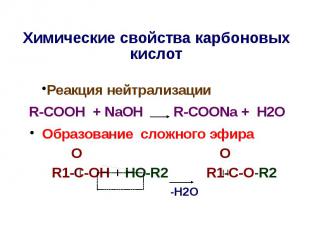
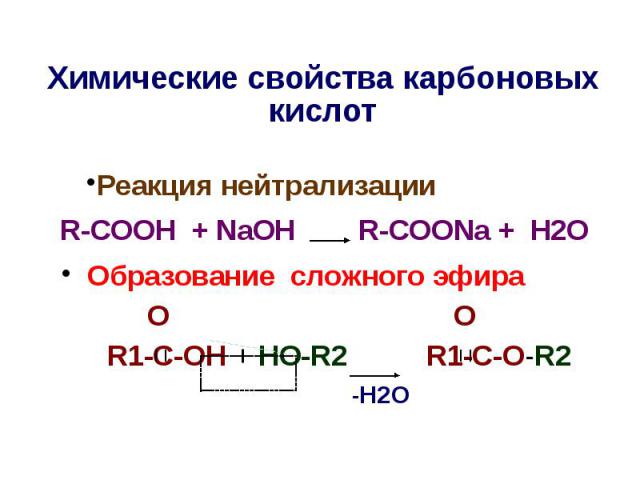
Химические свойства карбоновых киcлот Реакция нейтрализации R-COOH + NaOH R-COONa + H2O Образование сложного эфира O O R1-C-OH + HO-R2 R1-C-O-R2
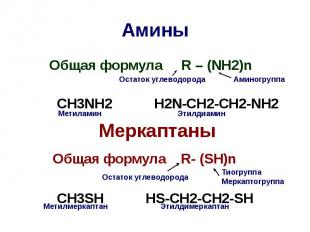
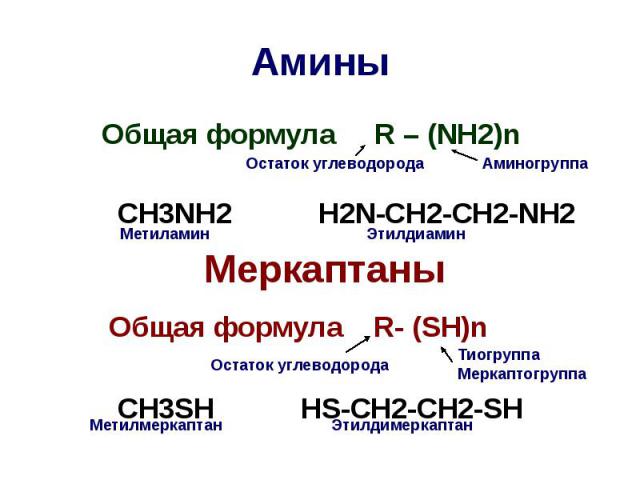
Амины Общая формула R – (NH2)n CH3NH2 H2N-CH2-CH2-NH2 Меркаптаны Общая формула R- (SH)n CH3SH HS-CH2-CH2-SH
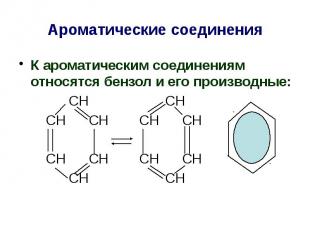
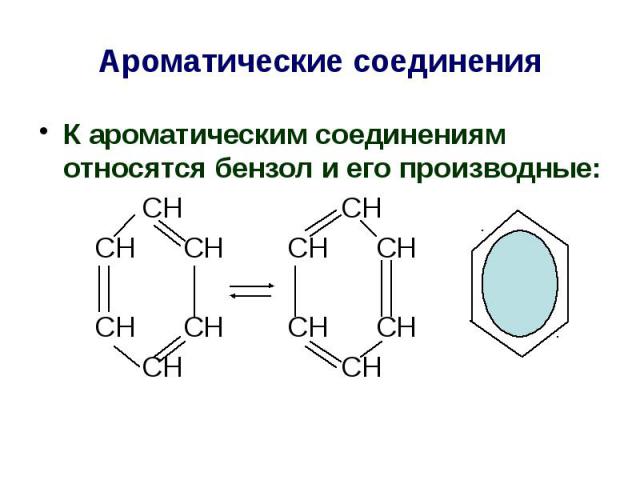
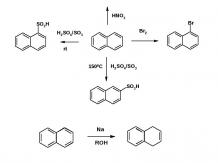
Ароматические соединения К ароматическим соединениям относятся бензол и его производные: СН СН СН СН СН СН СН СН СН СН СН СН
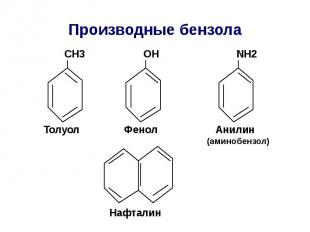
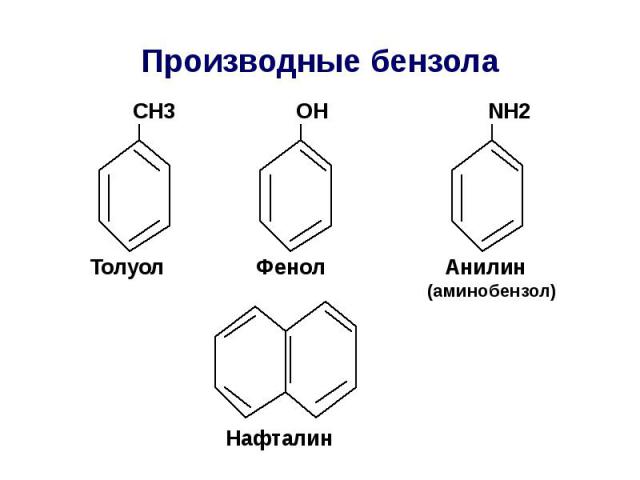
Производные бензола
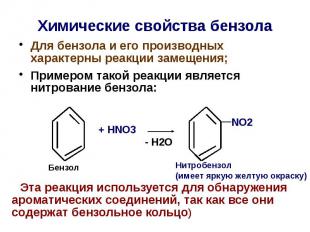
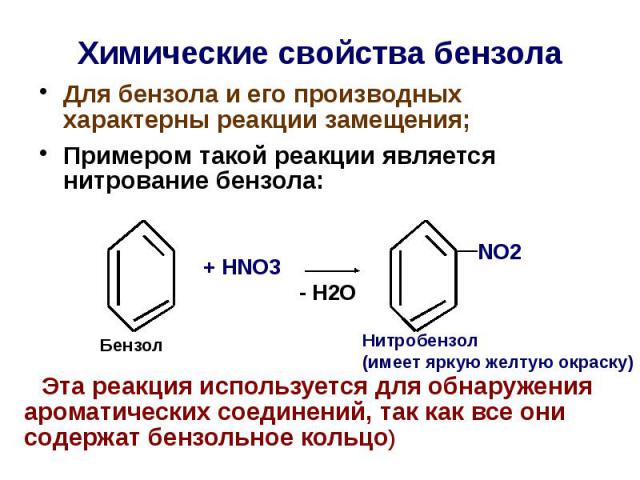
Химические свoйства бензола Для бензола и его производных характерны реакции замещения; Примером такой реакции является нитрование бензола:

Тест 1 Тест 1
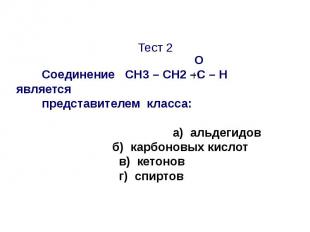
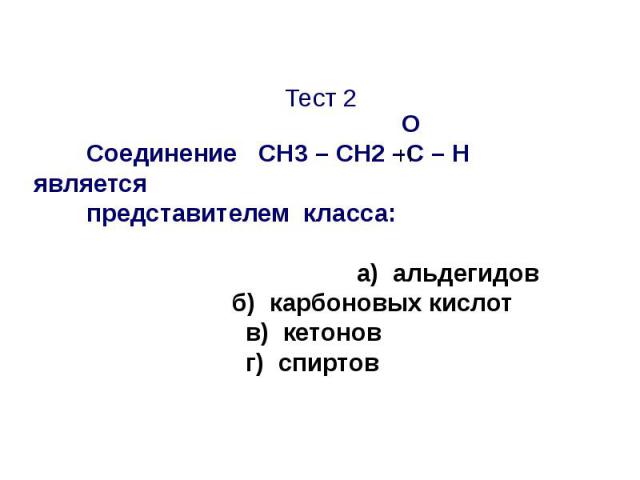
Тест 2

Тест 3


Тест 5

Тест 5 Тест 5
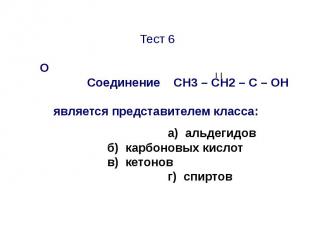

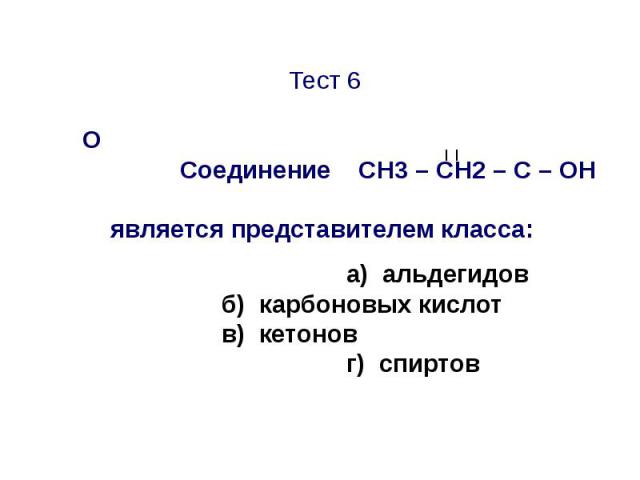
Тест 7

Тест 8

Тест 9

Тест 10

Тест 11

Тест 12

Успехов в учебе! Успехов в учебе! Удачи на экзамене!