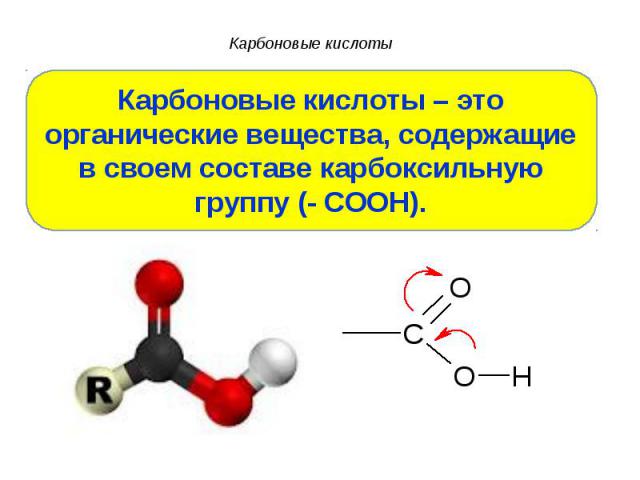
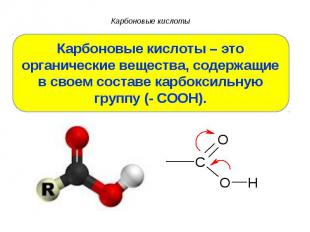
Презентация на тему: Презентация Карбоновые кислоты


I. По числу карбоксильных групп различают: I. По числу карбоксильных групп различают: монокарбоновые – содержат одну карбоксильную группу. Пример: гомологический ряд предельных одноосновных кислот CnH2n + 1COOH, n = 0, 1, 2, 3, 4 … HCOOH муравьиная (метановая) кислота (соли – формиаты)
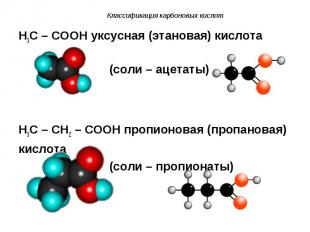
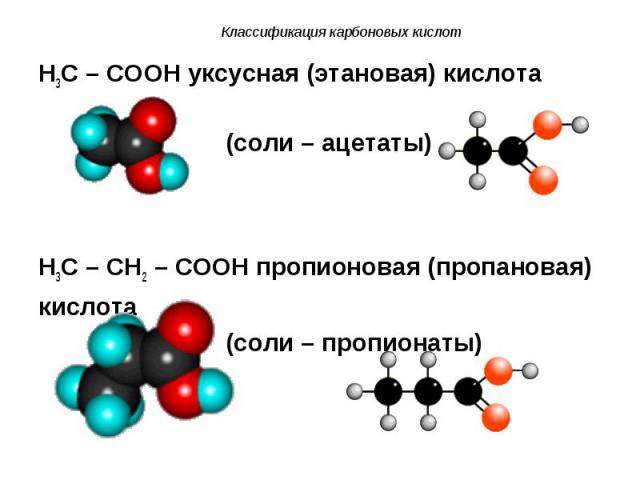
H3C – COOH уксусная (этановая) кислота H3C – COOH уксусная (этановая) кислота (соли – ацетаты) H3C – CH2 – COOH пропионовая (пропановая) кислота (соли – пропионаты)
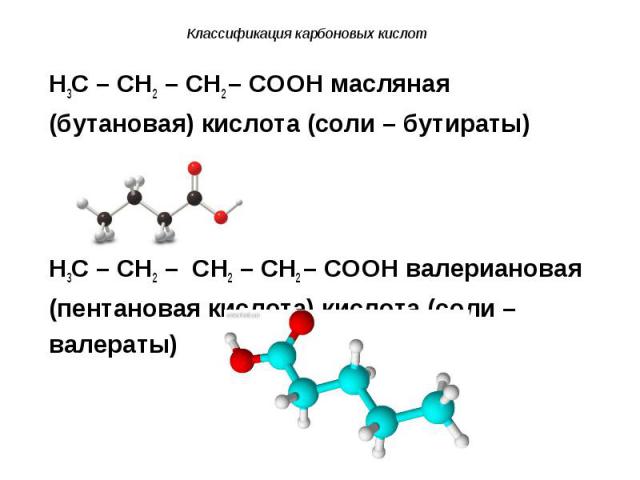
H3C – CH2 – CH2 – COOH масляная H3C – CH2 – CH2 – COOH масляная (бутановая) кислота (соли – бутираты) H3C – CH2 – CH2 – CH2 – COOH валериановая (пентановая кислота) кислота (соли – валераты)
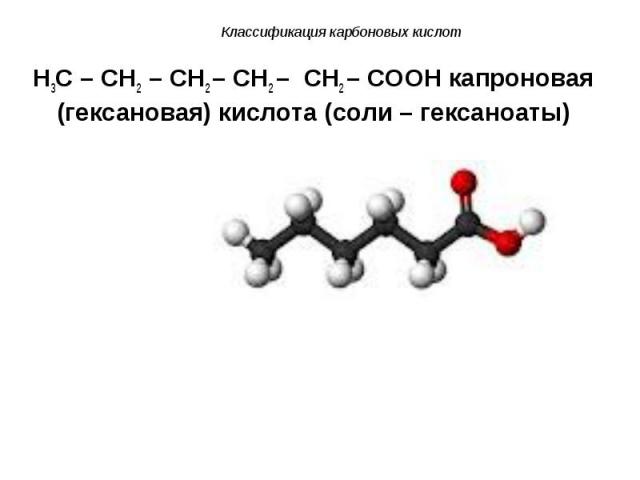
H3C – CH2 – CH2 – CH2 – CH2 – COOH капроновая (гексановая) кислота (соли – гексаноаты) H3C – CH2 – CH2 – CH2 – CH2 – COOH капроновая (гексановая) кислота (соли – гексаноаты)

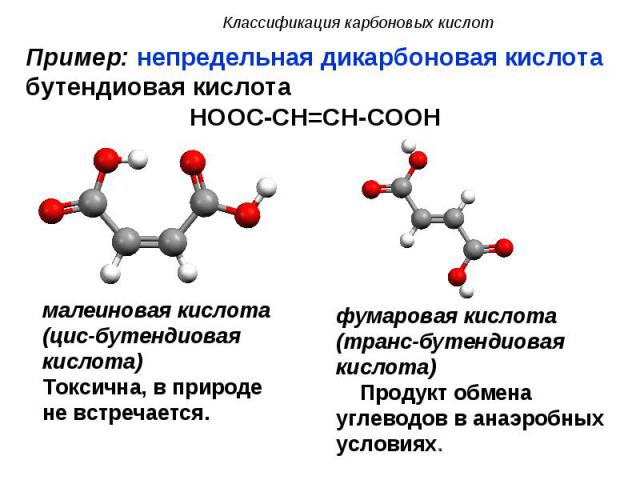
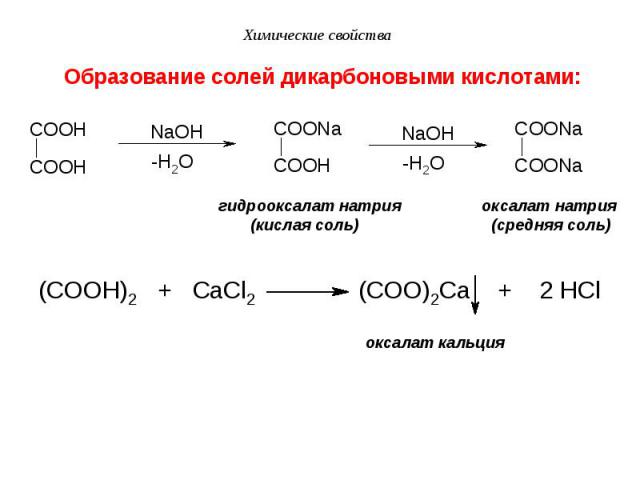
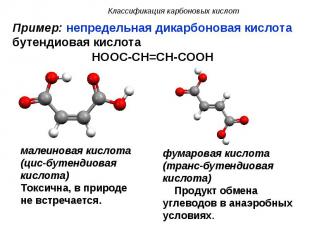
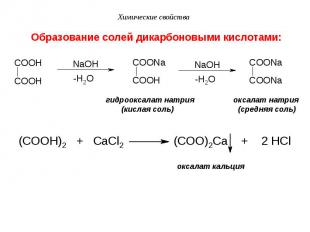
b) поликарбоновые – содержат в своем составе две и более карбоксильные группы. b) поликарбоновые – содержат в своем составе две и более карбоксильные группы. Пример: гомологический ряд предельных дикарбоновых кислот HOOC – CnH2n – COOH, n = 0, 1, 2, 3, 4 … HOOC – COOH щавелевая (этандиовая) кислота (соли – оксалаты), HOOC – CH2 – COOH малоновая (пропандиовая) кислота (соли – малонаты), HOOC – CH2 – CH2 – COOH янтарная (бутандиовая) кислота (соли – сукцинаты), HOOC – CH2 – CH2 – CH2 – COOH глутаровая (пентандиовая) кислота (соли – глутараты).
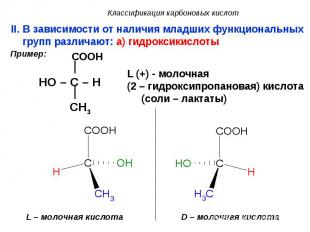
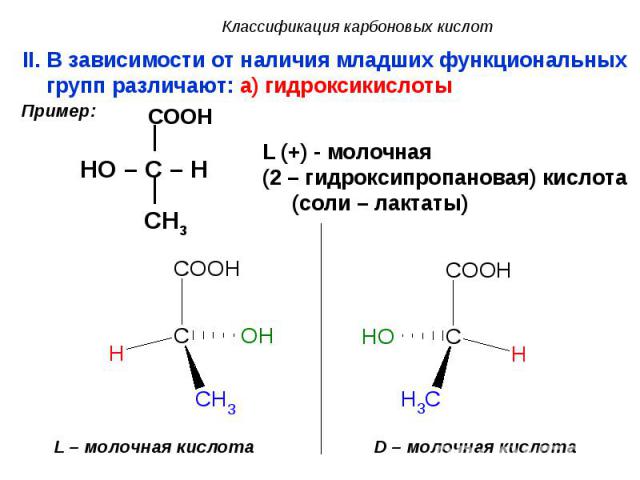
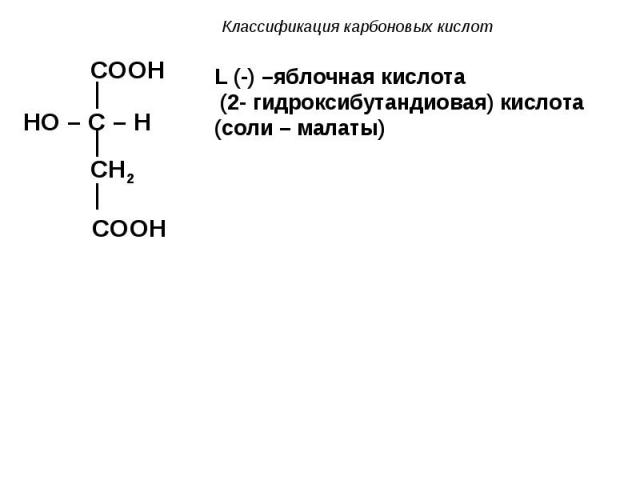
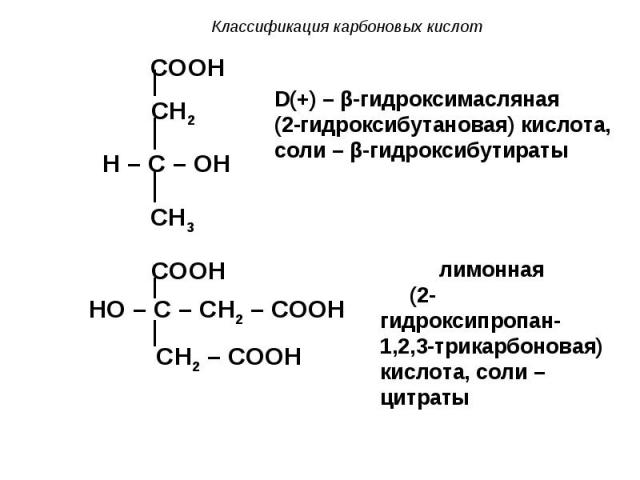
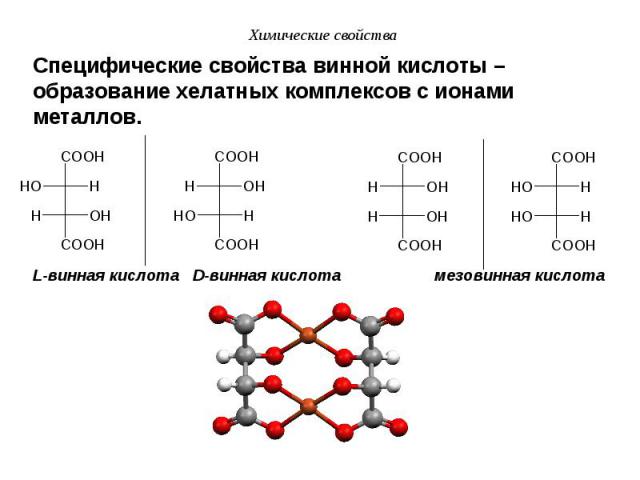
II. В зависимости от наличия младших функциональных групп различают: a) гидроксикислоты II. В зависимости от наличия младших функциональных групп различают: a) гидроксикислоты COOH
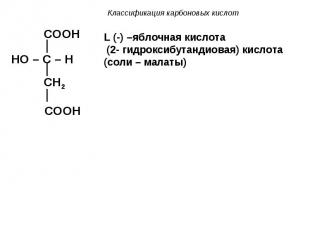
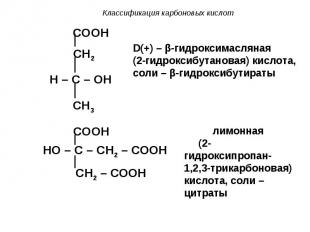

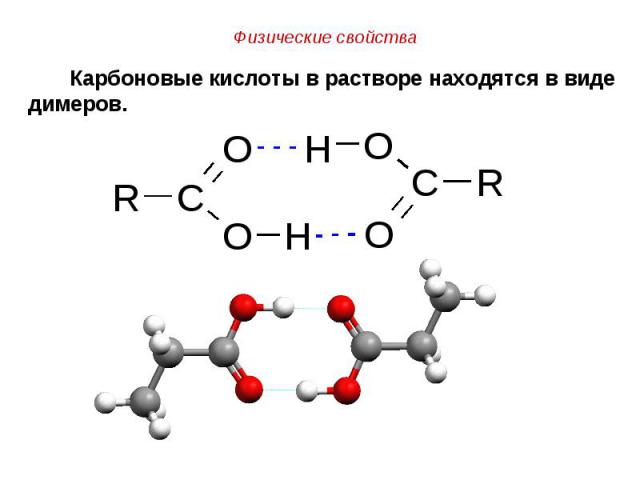
Гидроксикислоты являются, как правило, твёрдыми телами. Рацемическая молочная кислота может быть жидкой (т. пл. 18оС). Гидроксикислоты являются, как правило, твёрдыми телами. Рацемическая молочная кислота может быть жидкой (т. пл. 18оС). Запахом гидроксикислоты почти не обладают. Гидроксикислоты имеют очень большое значение в биологической химии; их можно встретить во многих очень важных метаболических путях – цикле Кребса, гликолизе, пентозофосфатном цикле, b-окислении жирных кислот, биосинтезе жирных кислот и т.д.
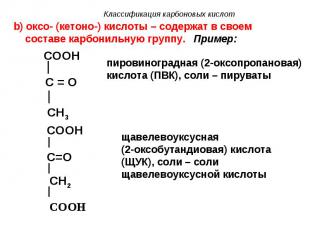
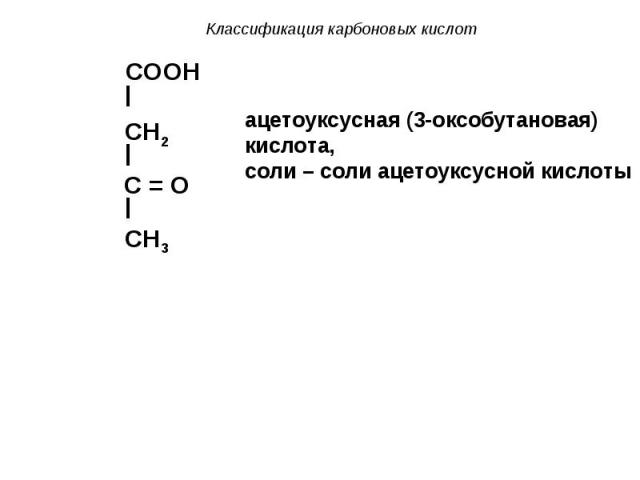
b) оксо- (кетоно-) кислоты – содержат в своем составе карбонильную группу. Пример: b) оксо- (кетоно-) кислоты – содержат в своем составе карбонильную группу. Пример: COOH

COOH COOH

III. Особую группу составляют высшие (жирные) карбоновые кислоты (ВЖК); входят в состав липидов. III. Особую группу составляют высшие (жирные) карбоновые кислоты (ВЖК); входят в состав липидов. Различают ВЖК: предельные. Пример: C15H31COOH – пальмитиновая кислота, C17H35COOH – стеариновая кислота, C23H47COOH – лигноцириновая кислота, C23H46 (OH)COOH – цереброновая кислота;

b) непредельные. b) непредельные. Пример: C17H33COOH – олеиновая кислота (одна двойная связь), C17H31COOH – линолевая кислота (две двойных связи), C17H29COOH – линоленовая кислота (три двойных связи), C23H45COOH – нервоновая кислота (одна двойная связь).

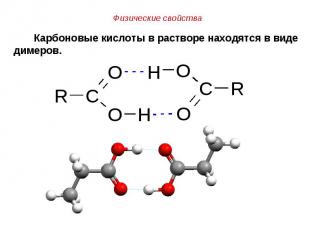
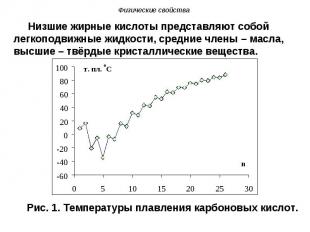
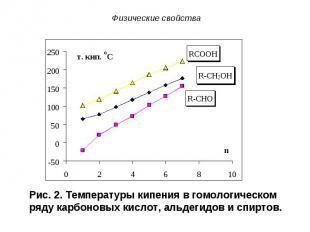

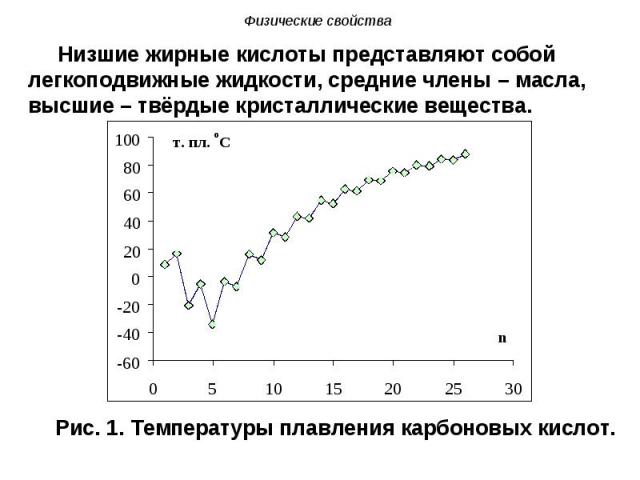
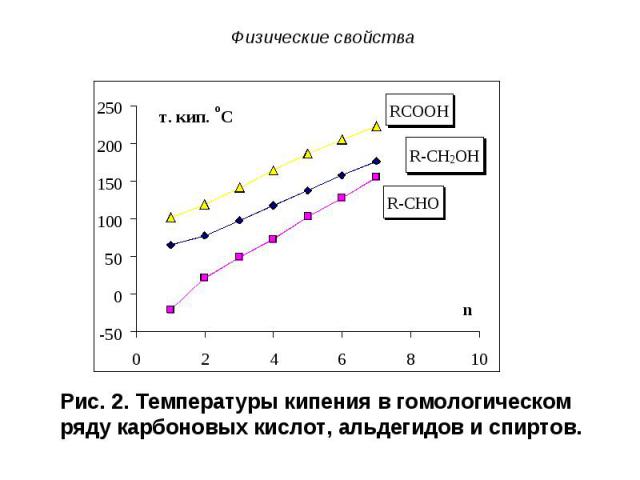
Первые члены гомологического ряда карбоновых кислот обладают резким запахом, средние – прогорклым, неприятным, например, масляная кислота пахнет потом, высшие карбоновые кислоты вследствие нелетучести лишены запаха. Первые члены гомологического ряда карбоновых кислот обладают резким запахом, средние – прогорклым, неприятным, например, масляная кислота пахнет потом, высшие карбоновые кислоты вследствие нелетучести лишены запаха. Карбоновые кислоты, как правило, не ядовиты, однако приём внутрь концентрированных растворов (например, уксусной эссенции) вызывает тяжёлые ожоги. Нежелательно попадание этих растворов на кожу и тем более внутрь.
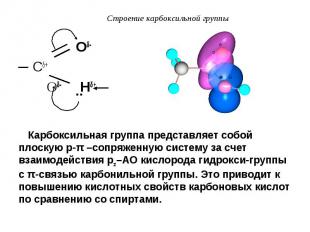
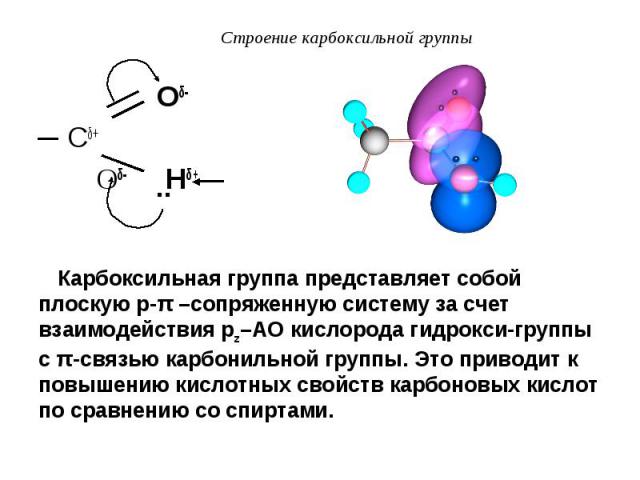
Оδ- Оδ- Сδ+ Оδ- Нδ+

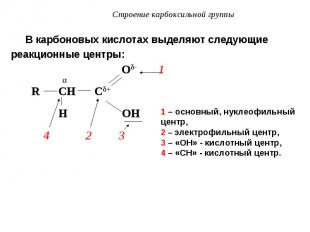
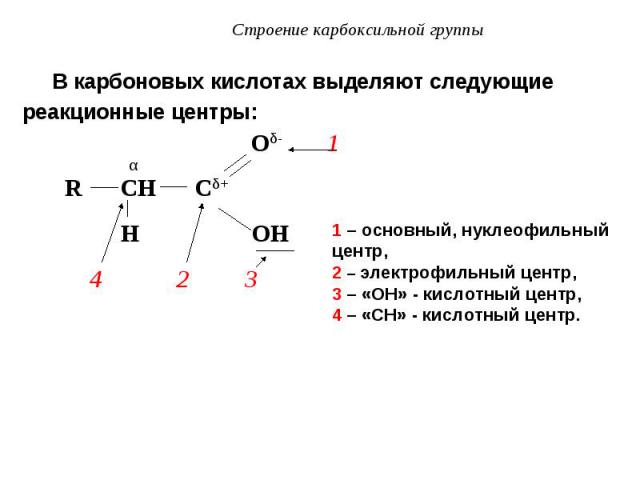
В карбоновых кислотах выделяют следующие В карбоновых кислотах выделяют следующие реакционные центры:
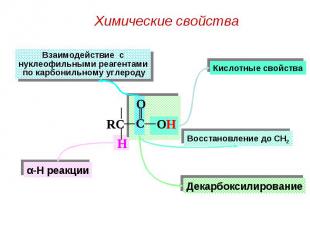
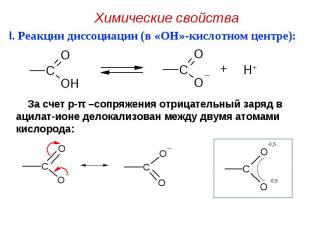
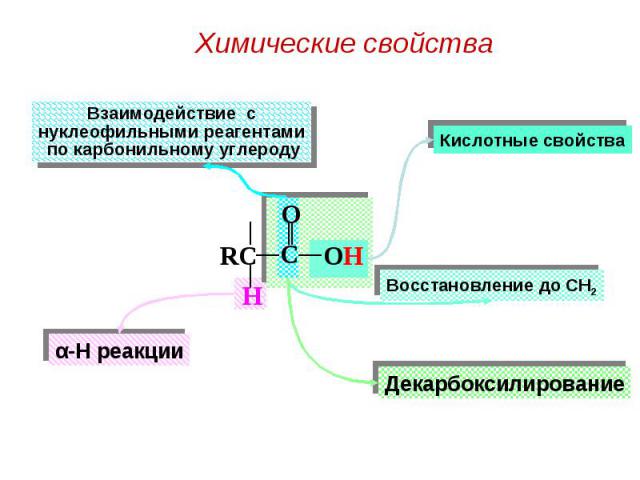
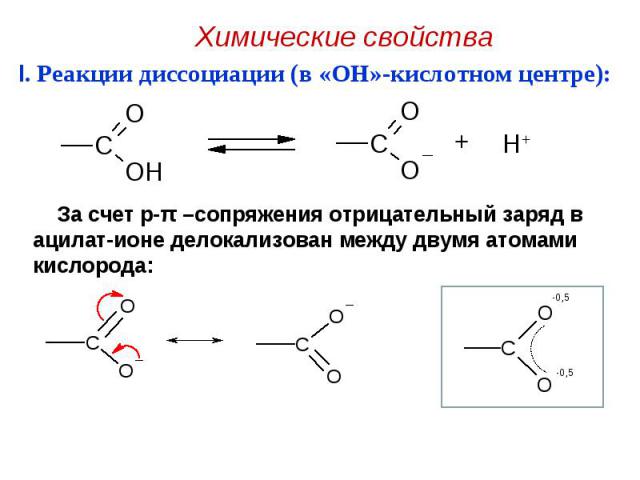
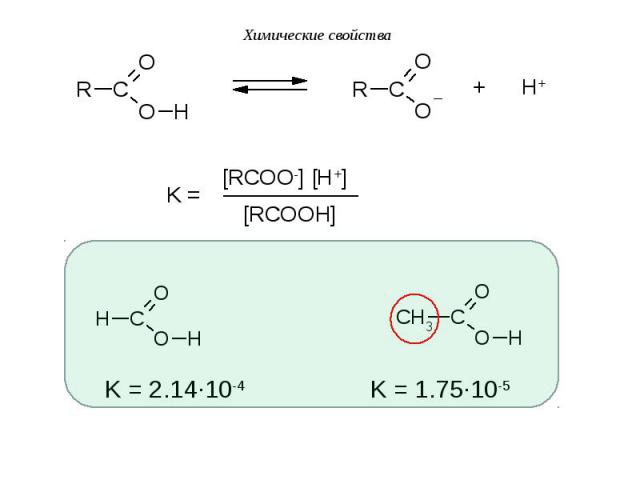
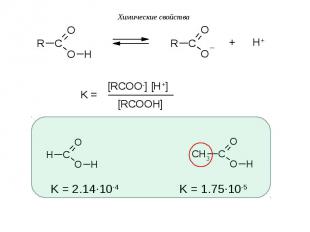
I. Реакции диссоциации (в «OH»-кислотном центре): I. Реакции диссоциации (в «OH»-кислотном центре):

II. Образование солей: II. Образование солей: а) С активными металлами: 2 CH3COOH + Mg → (CH3COO)2Mg + H2 б) С основными оксидами: 2 CH3COOH + CaO → (CH3COO)2Ca + H2O в) Со щелочами (реакция нейтрализации): CH3COOH + NaOH → CH3COONa + H2O г) С солями более слабых кислот: CH3COOH + NaHCO3 → CH3COONa + CO2 ↑+ H2O 2 CH3COOH + Na2CO3 → 2 CH3COONa + CO2 ↑+ H2O Эти реакции используются как качественные на карбоксильную группу (по выделению пузырьков CO2).



III. Реакции галогенирования (в СН - кислотном центре): III. Реакции галогенирования (в СН - кислотном центре):
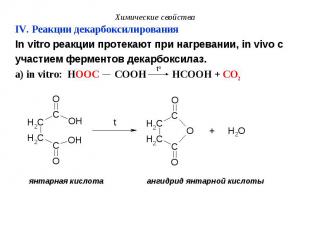
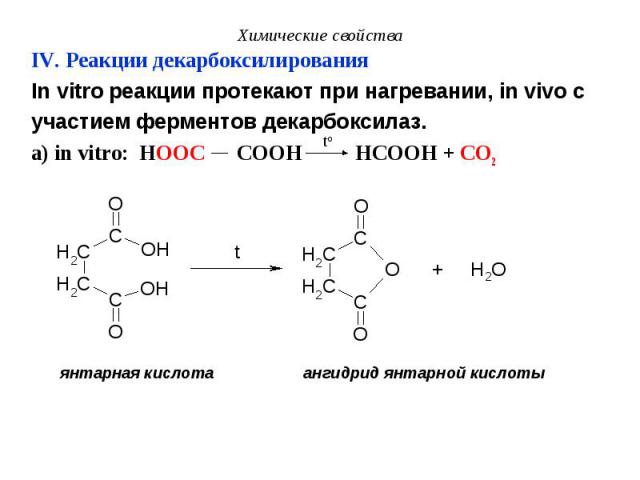
IV. Реакции декарбоксилирования IV. Реакции декарбоксилирования In vitro реакции протекают при нагревании, in vivo с участием ферментов декарбоксилаз. а) in vitro: HOOC COOH HCOOH + CO2
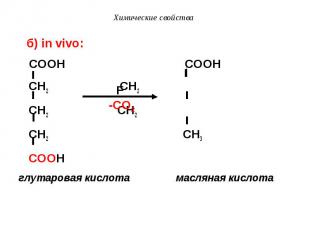
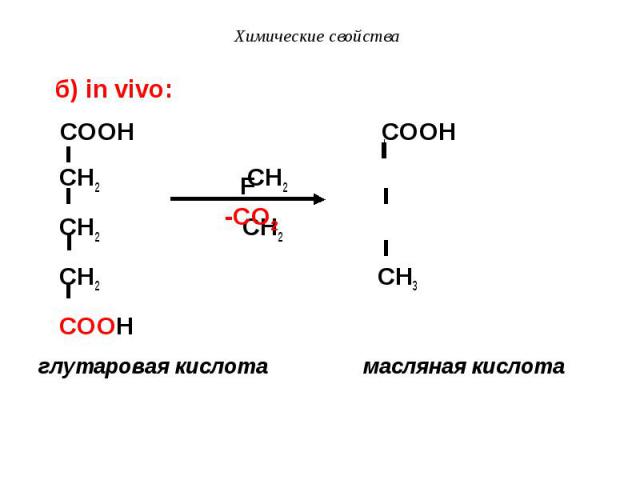
COOH COOH COOH COOH CH2 CH2 CH2 CH2 CH2 CH3 COOH глутаровая кислота масляная кислота
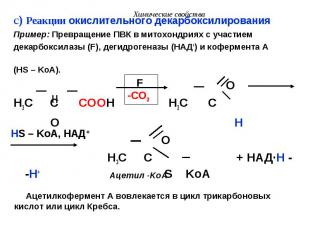
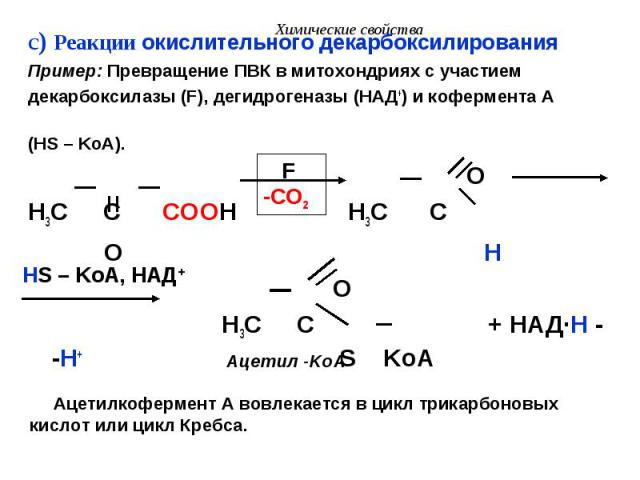
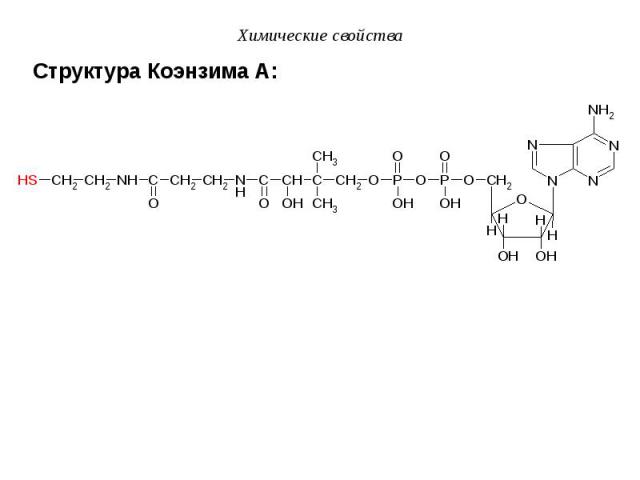
c) Реакции окислительного декарбоксилирования c) Реакции окислительного декарбоксилирования Пример: Превращение ПВК в митохондриях с участием декарбоксилазы (F), дегидрогеназы (НАД+) и кофермента А (HS – KoA). O H3C C COOH H3C C O H O H3C C + НАД·H - -H+ S KoA

V. Реакции этерификации или нуклеофильного V. Реакции этерификации или нуклеофильного замещения (SN)у sp2-гибридизованного атома углерода Пример:
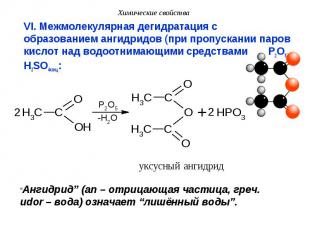
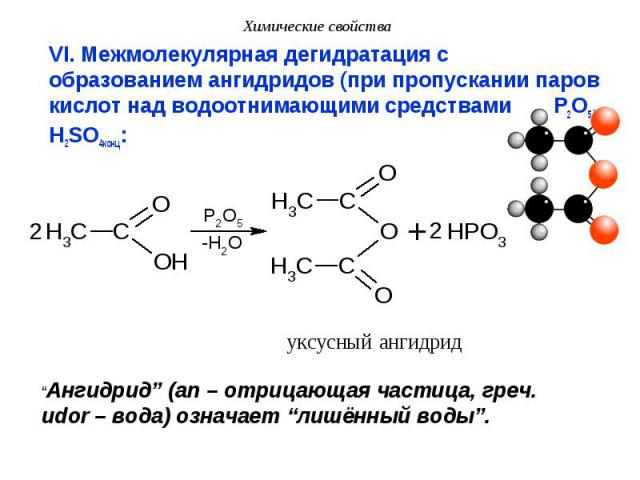
VI. Межмолекулярная дегидратация с образованием ангидридов (при пропускании паров кислот над водоотнимающими средствами P2O5, H2SO4конц: VI. Межмолекулярная дегидратация с образованием ангидридов (при пропускании паров кислот над водоотнимающими средствами P2O5, H2SO4конц:

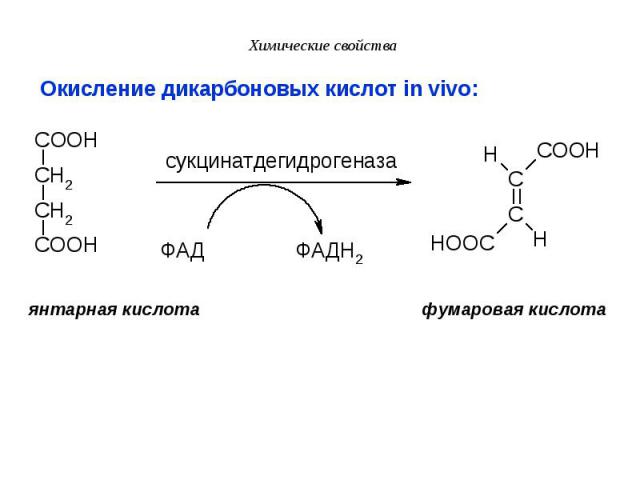
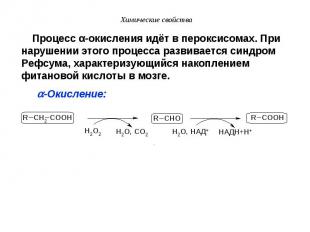
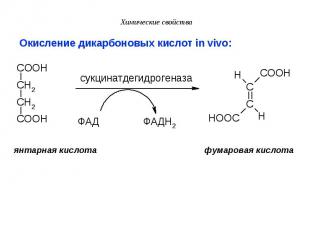
VII. Окисление карбоновых кислот VII. Окисление карбоновых кислот В организме карбоновые кислоты окисляются в основном за счёт т.н. b-окисления. Кроме того in vivo встречается также α- и w-окисление. In vitro некоторые аналогичные реакции b-окисления можно осуществить с помощью 3% перекиси водорода.
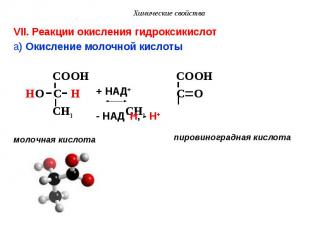
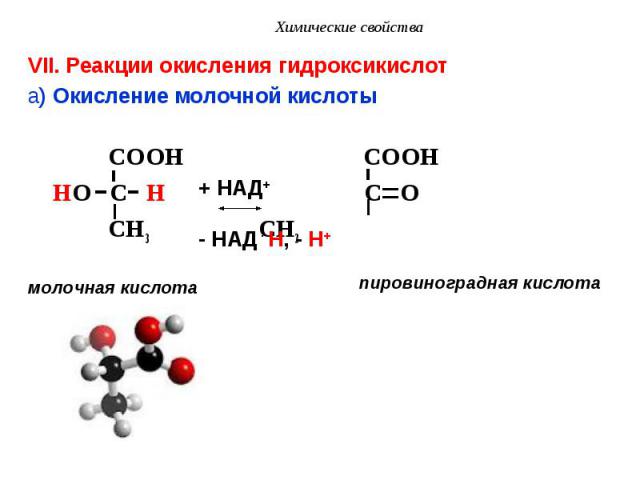
VII. Реакции окисления гидроксикислот VII. Реакции окисления гидроксикислот a) Окисление молочной кислоты COOH COOH HO C H C O CH3 CH3 молочная кислота
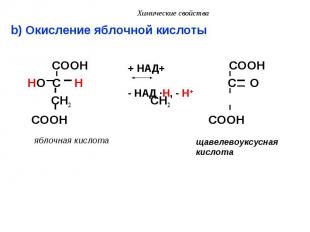
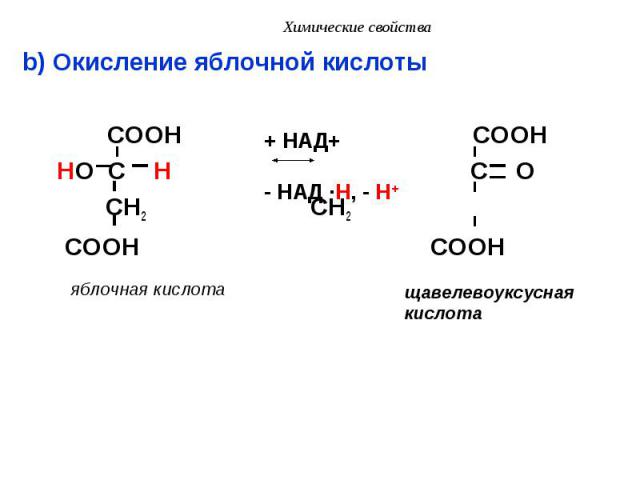
b) Окисление яблочной кислоты b) Окисление яблочной кислоты COOH COOH HO C H C O CH2 CH2 COOH COOH
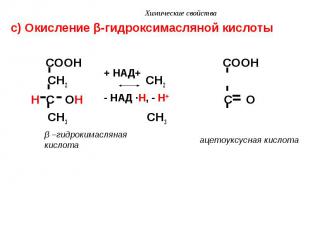
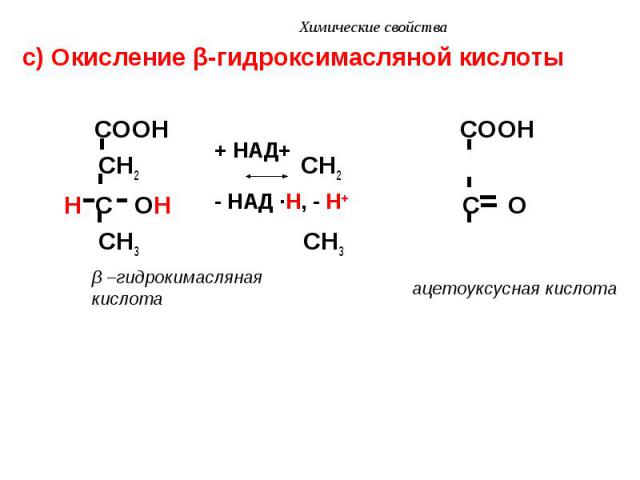
с) Окисление β-гидроксимасляной кислоты с) Окисление β-гидроксимасляной кислоты COOH COOH CH2 CH2 H C OH C O CH3 CH3
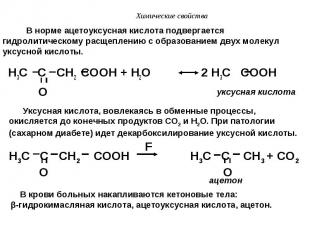
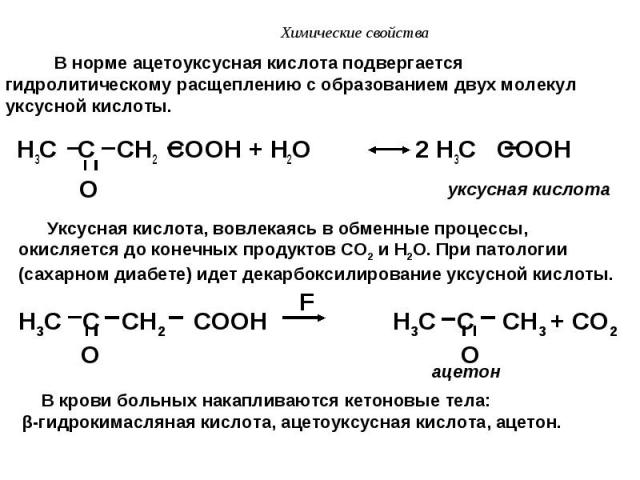
H3C C CH2 COOH + H2O 2 H3C COOH O

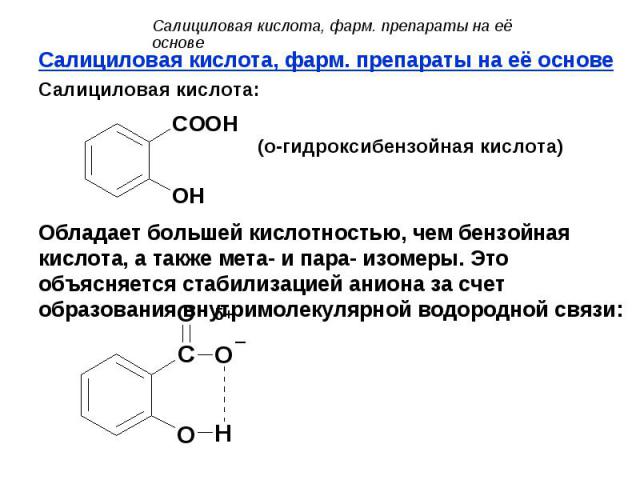
Салициловая кислота, фарм. препараты на её основе Салициловая кислота, фарм. препараты на её основе Салициловая кислота: (о-гидроксибензойная кислота) Обладает большей кислотностью, чем бензойная кислота, а также мета- и пара- изомеры. Это объясняется стабилизацией аниона за счет образования внутримолекулярной водородной связи:


Метилсалицилат: Метилсалицилат: Используется как противовоспалительное, анальгетическое средство наружно (в виде мазей).
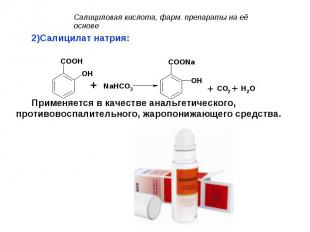
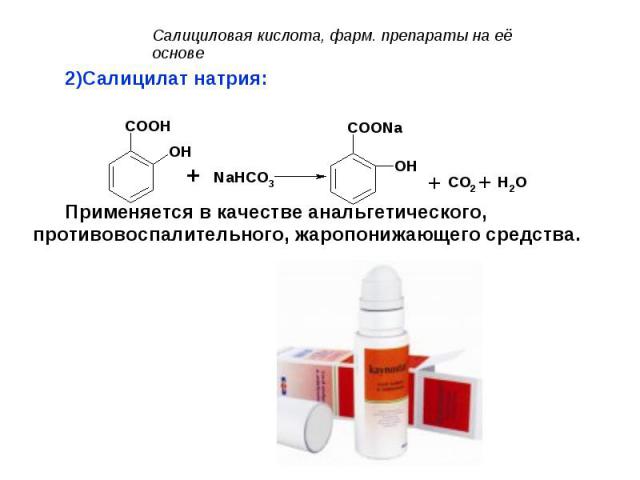
Салицилат натрия: Салицилат натрия: Применяется в качестве анальгетического, противовоспалительного, жаропонижающего средства.
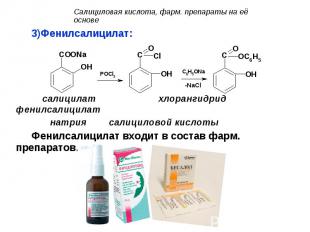
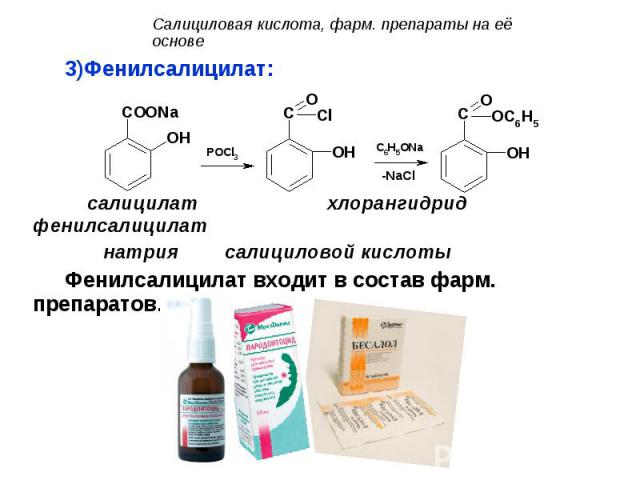
Фенилсалицилат: Фенилсалицилат: салицилат хлорангидрид фенилсалицилат натрия салициловой кислоты Фенилсалицилат входит в состав фарм. препаратов.
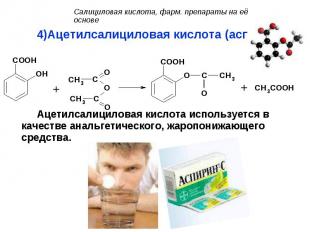
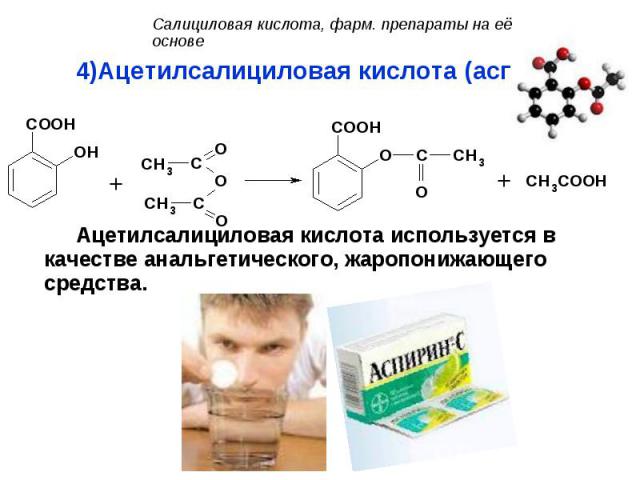
Ацетилсалициловая кислота (аспирин): Ацетилсалициловая кислота (аспирин): Ацетилсалициловая кислота используется в качестве анальгетического, жаропонижающего средства.