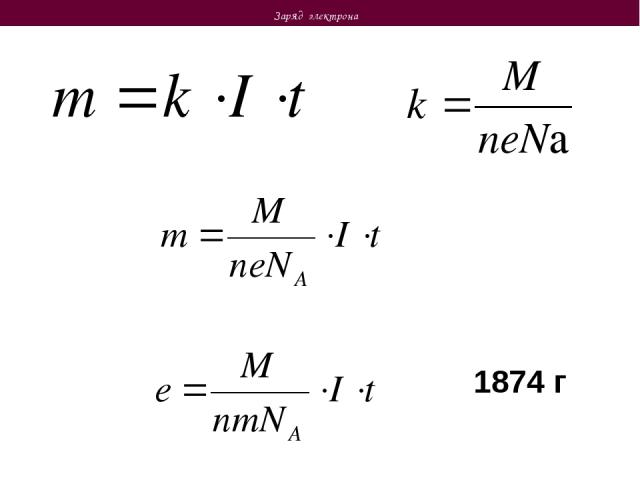Презентация на тему: Применение электролиза

Электрический ток в различных средах 900igr.net

ВОПРОСЫ: Электролитическая диссоциация Электрический ток в электролитах. Электролиз Законы электролиза Применение электролиза

Электролитическая диссоциация Вопрос 1

Электролитическая диссоциация По электрическим свойствам все жидкости можно разделить на 2 группы: ЖИДКОСТИ ПРОВОДЯЩИЕ НЕПРОВОДЯЩИЕ Содержащие свободные заряженные частицы (диссоциирующие) - электролиты Не содержащие свободные заряженные частицы (недиссоциирующие) К ним относятся растворы (чаще всего водные) и расплавы солей, кислот и оснований К ним относятся дистилированная вода, спирт, минеральное масло… Электролитической диссоциацией называется распад нейтральных молекул вещества в растворителе на положительные и отрицательные ионы

Электролитическая диссоциация Na Cl Na+ Cl- Электролитическая диссоциация поваренной соли NaCl Na+ + Cl- Диссоциация других веществ: CuSO4 Cu 2+ + SO42- HCl H + + Cl- H2SO4 H+ + H+ + SO42- CaCl2 Ca 2+ + Cl- + Cl- При диссоциации ионы металлов и водорода всегда заряжены положительно, а ионы кислотных радикалов и группы ОН - отрицательно

Электрический ток в электролитах. Электролиз Вопрос 2

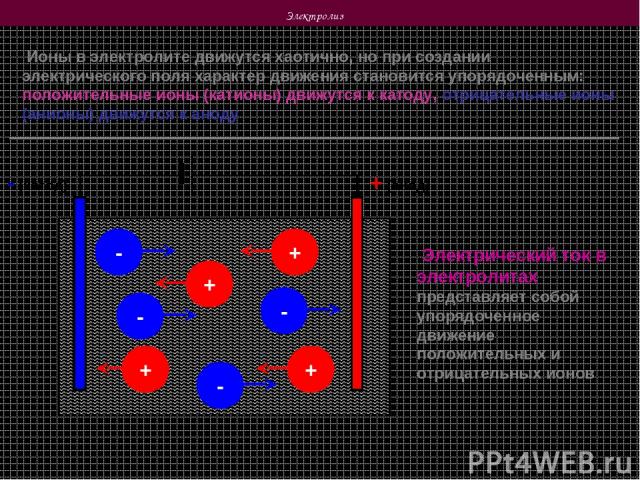
Электролиз Ионы в электролите движутся хаотично, но при создании электрического поля характер движения становится упорядоченным: положительные ионы (катионы) движутся к катоду, отрицательные ионы (анионы) движутся к аноду + (анод) - (катод) + + + - - - + - Электрический ток в электролитах представляет собой упорядоченное движение положительных и отрицательных ионов
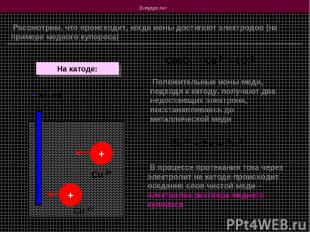
Электролиз Рассмотрим, что происходит, когда ионы достигают электродов (на примере медного купороса) CuSO4 Cu 2+ + SO42- + + - (катод) Положительные ионы меди, подходя к катоду, получают два недостающих электрона, восстанавливаясь до металлической меди В процессе протекания тока через электролит на катоде происходит оседание слоя чистой меди – электролиз раствора медного купороса Cu 2+ + 2 е Cu 0 На катоде: Cu 2+ Cu 2+

Электролиз На аноде: + (анод) - - Выделение вещества на электродах вследствие окислительно – восстановительных реакций при прохождении тока через электролит называется электролизом Сульфат - ионы SO42- , подходя к аноду, отдают ему два лишних электрона, которые через источник тока поступают на катод и присоединяются к положительным ионам меди SO42- SO42-

Законы электролиза Вопрос 3
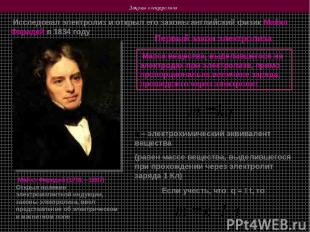
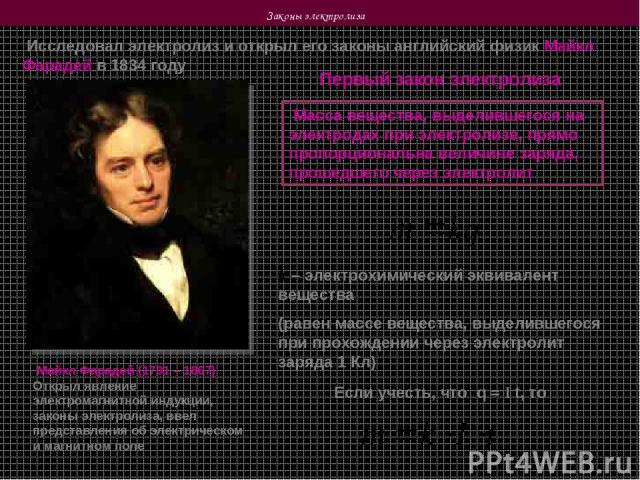
Законы электролиза Исследовал электролиз и открыл его законы английский физик Майкл Фарадей в 1834 году Майкл Фарадей (1791 – 1867) Открыл явление электромагнитной индукции, законы электролиза, ввел представления об электрическом и магнитном поле Первый закон электролиза Масса вещества, выделившегося на электродах при электролизе, прямо пропорциональна величине заряда, прошедшего через электролит k – электрохимический эквивалент вещества (равен массе вещества, выделившегося при прохождении через электролит заряда 1 Кл) Если учесть, что q = I t, то
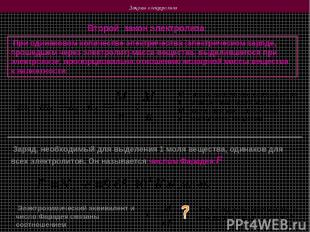
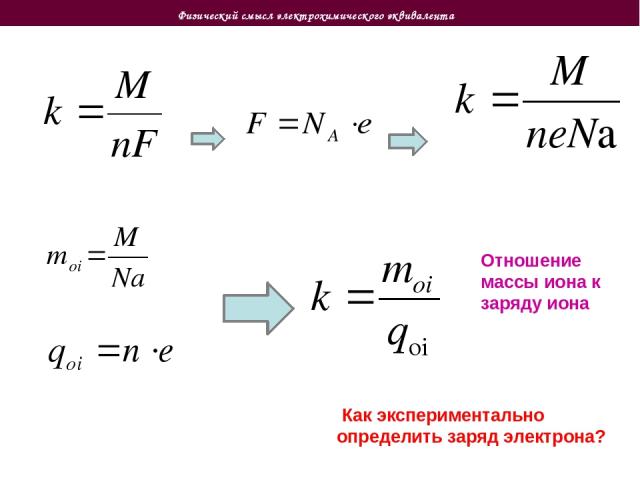
Законы электролиза Второй закон электролиза При одинаковом количестве электричества (электрическом заряде, прошедшем через электролит) масса вещества, выделившегося при электролизе, пропорциональна отношению молярной массы вещества к валентности M – масса выделившегося вещества k – электрохимический эквивалент М – молярная масса вещества n – валентность вещества Заряд, необходимый для выделения 1 моля вещества, одинаков для всех электролитов. Он называется числом Фарадея F Электрохимический эквивалент и число Фарадея связаны соотношением Как отсюда экспериментально определить заряд электрона?

Физический смысл электрохимического эквивалента Как экспериментально определить заряд электрона? Отношение массы иона к заряду иона
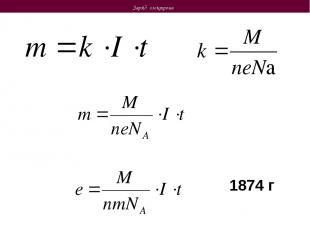
Заряд электрона 1874 г

Зависимость сопротивления электролита от температуры Температурная зависимость сопротивления электролита объясняется в основном изменением удельного сопротивления. ,где альфа - температурный коэффициент сопротивления. Для электролитов всегда поэтому Сопротивление электролита можно рассчитать по формуле:

Применение электролиза Вопрос 4
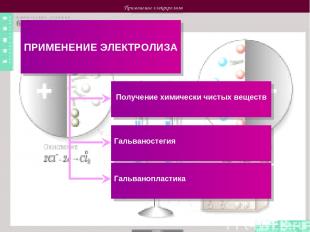
Применение электролиза ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА Получение химически чистых веществ Гальваностегия Гальванопластика

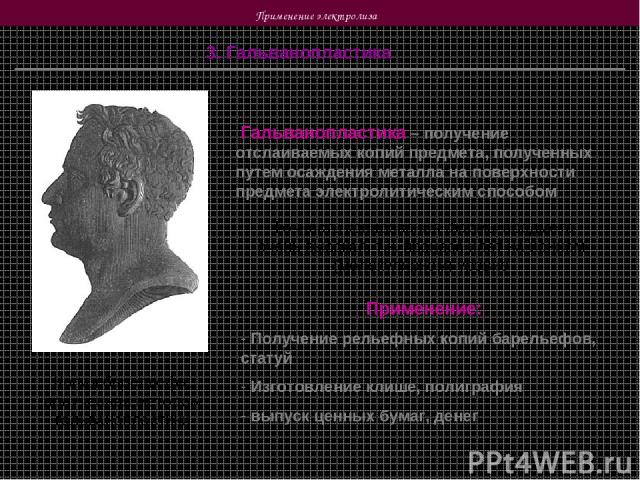
Применение электролиза Основателем гальванотехники и ее широчайшего применения является Б. С. Якоби, который изобрел в 1836 году гальванопластику Борис Семенович Якоби (1801 – 1874) – русский академик, открывший гальванопластику, создавший первую конструкцию электродвигателя Гальванотехника - это отрасль прикладной электрохимии, смысл которой состоит в получении электролитическим путем металлических копий каких-либо предметов (гальванопластика) или же в нанесении этим же способом металлических покрытий на какие-либо поверхности (гальваностегия). Способ этот в свое время широко использовался в полиграфической промышленности и в определенных случаях применяется и сейчас
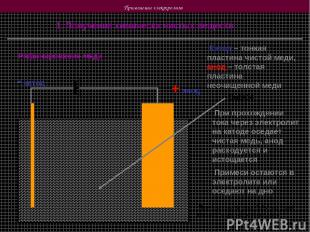
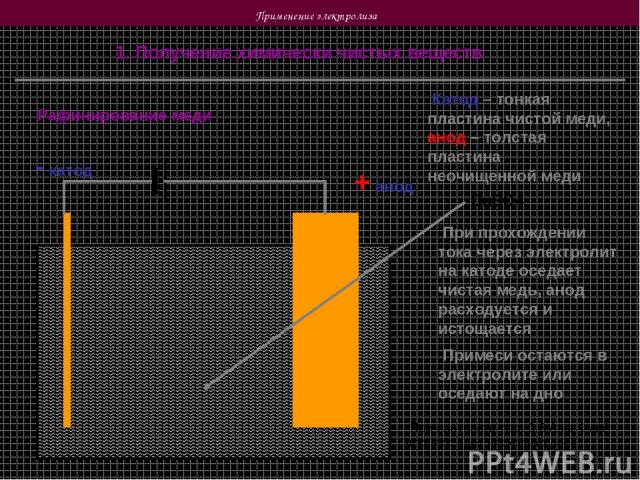
Применение электролиза 1. Получение химически чистых веществ Рафинирование меди + анод - катод Катод – тонкая пластина чистой меди, анод – толстая пластина неочищенной меди CuSO4 При прохождении тока через электролит на катоде оседает чистая медь, анод расходуется и истощается Примеси остаются в электролите или оседают на дно При плотности тока 0,3 А на 1 дм2 процесс идет несколько дней

Применение электролиза 1. Получение химически чистых веществ Получение алюминия Алюминий получают электролитическим способом из глинозема (вспомните – алюминий является одним из самых распространенных химических элементов земной коры и содержится в любой глине) Электролитическим способом получают: Магний, натрий, калий, кальций … Соду, хлор, хлористый кальций … Осуществив, например, электролиз раствора поваренной соли NaCl, мы можем получить сразу 3 полезных химических вещества: Газообразные водород и хлор, а также раствор едкого натра NaOH

Применение электролиза 2. Гальваностегия Гальваностегия – покрытие предметов неокисляющимся металлами для защиты от коррозии (Ni, Zn, Ag, Au, Cu) Приведите примеры защитных покрытий в быту и технике

Применение электролиза 3. Гальванопластика Копия барельефа, полученная методом гальванопластики Гальванопластика – получение отслаиваемых копий предмета, полученных путем осаждения металла на поверхности предмета электролитическим способом Точность копирования формы предмета очень высокая, т.к. процесс идет на ионном (молекулярном) уровне Применение: Получение рельефных копий барельефов, статуй Изготовление клише, полиграфия выпуск ценных бумаг, денег

Применение электролиза Кроме указанных выше, электролиз нашел применение и в других областях: получение оксидных защитных пленок на металлах (анодирование); электрохимическая обработка поверхности металлического изделия (полировка); электрохимическое окрашивание металлов (например, меди, латуни, цинка, хрома и др.); очистка воды - удаление из нее растворимых примесей. В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной); электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т.д.).

Домашнее задание: пп. 79, 80 стр. 200 упр.12 (4,5,7)