Презентация на тему: Применение первого закона термодинамики

Первый закон термодинамики 1. Два принципа (начала) первого закона термодинамики. 2. Внутренняя энергия и работа расширения газа. 4. Энтальпия и энтропия газа. 900igr.net

1. Два принципа первого закона термодинамики Первый закон термодинамики является частным случаем всеобщего закона о превращении и сохранении энергии применительно к тепловым процессам. Первый закон термодинамики состоит из двух принципов (начал). Первый закон называется принципом эквивалентности теплоты и работы. Теплота Q и работа L преобразовываются друг в друга в строго эквивалентном соотношении: Второй принцип гласит – теплота, сообщенная телу (системе) расходуется на изменение его внутренней энергии и на совершение работы этим телом (системой).

Примечание. В данном уравнении и в дальнейшем удобнее расчет вести на единицу вещества – кг, м3, моль. Поэтому расчетные величины обозначаются прописными буквами, а не заглавными, при этом необходимо помнить, что для удобства и сокращения термин «удельная» опускается, но подразумевается. Например, в предыдущем уравнении Q – теплота, подведенная к 1кг вещества, Дж/кг; U1, U2 – начальная и конечная внутренняя энергия тела, отнесенная к 1кг вещества, Дж/кг; ∆U – изменение внутренней энергии 1кг вещества, Дж/кг; l – работа, совершенная 1кг вещества (в данном случае газа), Дж/кг.

2. Внутренняя энергия газа Внутренняя энергия – это сумма кинетических энергий частиц (молекул, атомов) газа и зависит она только от температуры – т.е. интенсивности движения частиц газа, что и определяет их тепловое состояние. Для расчетов не столь важно знать, какова внутренняя энергия газа, а важно знать, на сколько она изменяется.
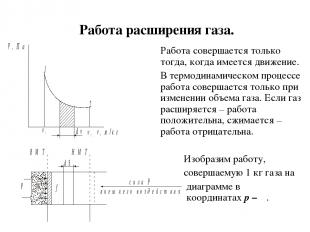
Работа расширения газа. Работа совершается только тогда, когда имеется движение. В термодинамическом процессе работа совершается только при изменении объема газа. Если газ расширяется – работа положительна, сжимается – работа отрицательна. Изобразим работу, совершаемую 1 кг газа на диаграмме в координатах p – υ.

Пусть в процессе 1-2 поршень перемещается из положения 1 – верхней мертвой точки (ВМТ) в положение 2 – нижней мертвой точки и преодолевает силу Р внешнего воздействия под давлением р рабочего тела. При этом газ расширяется от υ1 до υ2, оказывая давление р на днище поршня площадью f. Работа всегда определяется произведением силы Р на перемещение S. Тогда элементарная работа dl при перемещении на элементарном отрезке dS будет равна:

Учитывая, что fdS=dv, работа расширения газа на всем участке от v1 до v2 будет равна: При р = const l=p(v2-v1); При v=const l=0.

3. Энтальпия газа Энтальпия газа h, Дж/кг равна сумме внутренней энергии газа и произведения давления на объем. Физический смысл величины pv понятен из рисунка – это потенциальная энергия сжатого газа. Она уравновешивает воздействие потенциальной энергии гири и поршня, поднятых на высоту H по отношению к днищу поршня.

Изменение энтальпии равно: Учитывая, что получим: После интегрирования в пределах от Т1 до Т2 получим:

Энтропия газа Не всегда количество подведенной можно определить через изменение температуры тела. Например, вода кипит, а ее температура остается постоянной. В выражении первого закона термодинамики: выражение не является полным дифференциалом, поскольку неизвестна зависимость изменения р от температуры Т. (1)

Если количество подведённой теплоты не характеризуется соответствующим изменением температуры, то выражение (1) можно превратить в полный дифференциал, если его левую и правую часть разделить на температуру тела Т. Умножив и разделив второе слагаемое на υ, получим:

Обозначив после сокращения на Т получим: Изменение энтропии ΔS будет равно: Изменение энтропии равно подведенной теплоте, отнесенной к температуре тела. Энтропия – есть теплота, отнесенная к температуре тела.