Презентация на тему: Законы электролиза

ЭЛЕКТРОЛИЗ © Столбов Ю.Ф., учитель физики ГОУ СОШ №156 Санкт-Петербург 2007 900igr.net

СОДЕРЖАНИЕ Основные понятия Ионная проводимость Вывод формулы Первый закон электролиза Второй закон электролиза Объединённый закон электролиза Применение электролиза ВЫХОД
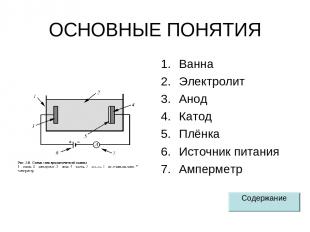
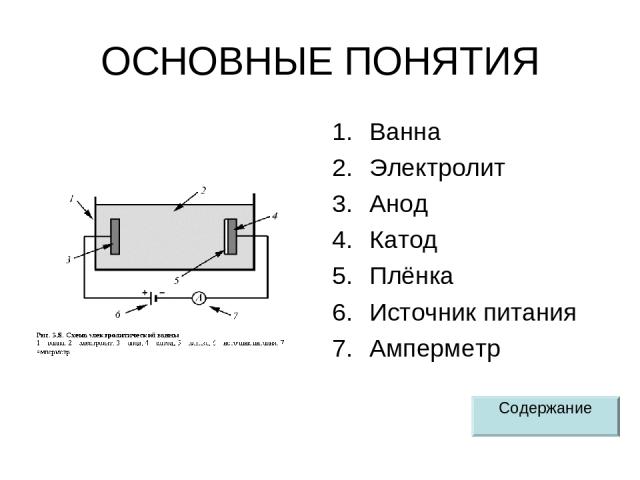
ОСНОВНЫЕ ПОНЯТИЯ Ванна Электролит Анод Катод Плёнка Источник питания Амперметр Содержание

ОПРЕДЕЛЕНИЯ Электролизом называется процесс выделения вещества на электроде, связанный с окислительно-восстановительными реакциями. Электролиты-вещества,растворы которых проводят электрический ток ионами,образующимися в результате электролитической диссоциации содержание

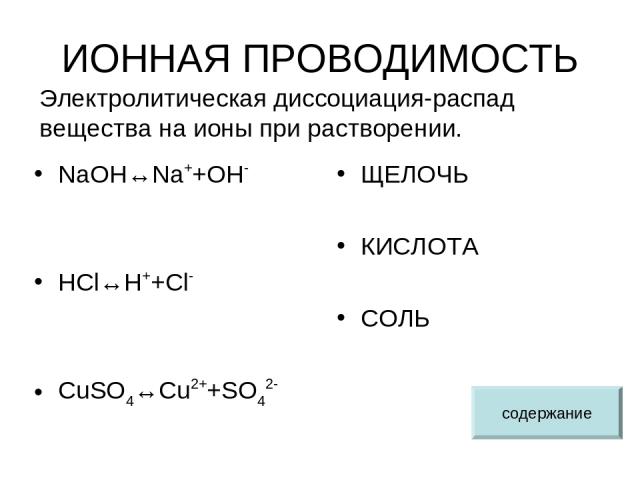
ИОННАЯ ПРОВОДИМОСТЬ NaOH↔Na++OH- HCl↔H++Cl- CuSO4↔Cu2++SO42- ЩЕЛОЧЬ КИСЛОТА СОЛЬ Электролитическая диссоциация-распад вещества на ионы при растворении. содержание

ВЫВОД ФОРМУЛЫ m=Nm m0=M/Na q=Nq0 N-число ионов m0-масса иона M-молярная масса Na-число Авогадро N-число ионов q0-заряд иона содержание

ПЕРВЫЙ ЗАКОН ЭЛЕКТРОЛИЗА m=kq m-масса вещества q-перенесённый заряд k-электрохимический эквивалент содержание

ВТОРОЙ ЗАКОН ЭЛЕКТРОЛИЗА k=(1/F)X F=96500Кл/кг X=M/z k-электрохимический эквивалент F-постоянная Фарадея X-химический эквивалент z-валентность содержание

ОБЪЕДИНЁННЫЙ ЗАКОН ЭЛЕКТРОЛИЗА m=(1/F)(M/z)It M-масса вещества F-постоянная Фарадея M-молярная масса z-валентность I-сила тока t-время содержание

ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА содержание