Презентация на тему: Взаимодействие кислот

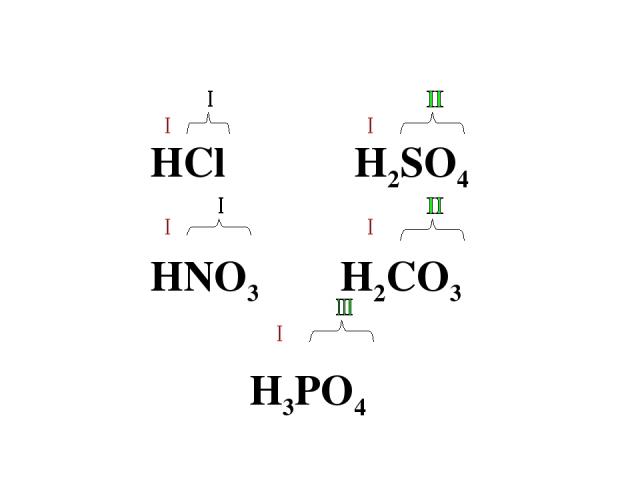
H+n R-n, где R- кислотный остаток ; n- число атомов водорода, равное валентности кислотного остатка. Неорганические кислоты- это сложные неорганические вещества, молекулы которых содержат один или несколько атомов водорода, способных замещаться на атомы металлов, и кислотного остатка. 900igr.net
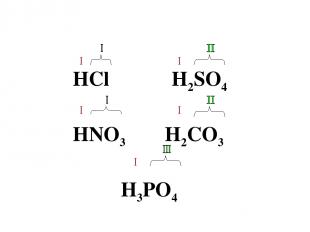
HCl H2SO4 HNO3 H2CO3 H3PO4
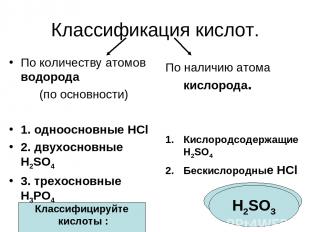
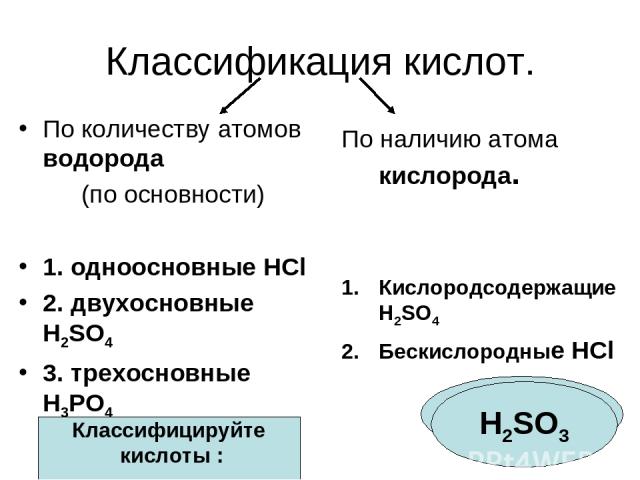
Классификация кислот. По количеству атомов водорода (по основности) 1. одноосновные HCl 2. двухосновные H2SO4 3. трехосновные H3PO4 По наличию атома кислорода. Кислородсодержащие H2SO4 Бескислородные HCl Классифицируйте кислоты : HF H2SO3
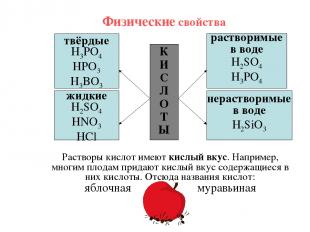
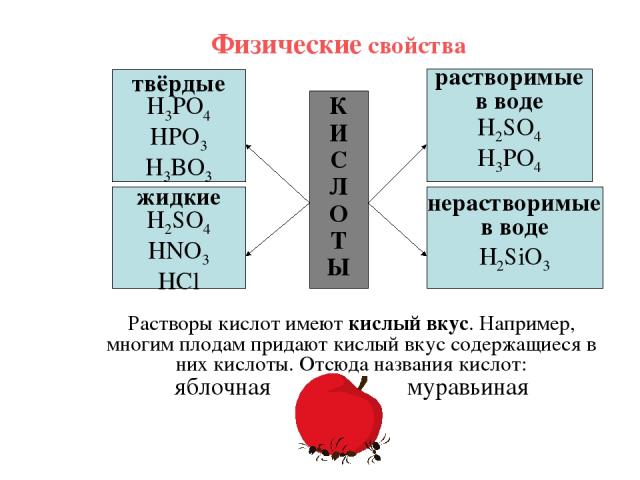
Физические свойства К И С Л О Т Ы твёрдые H3PO4 HPO3 H3BO3 жидкие H2SO4 HNO3 HCl растворимые в воде H2SO4 H3PO4 нерастворимые в воде H2SiO3 Растворы кислот имеют кислый вкус. Например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: яблочная муравьиная лимонная щавелевая
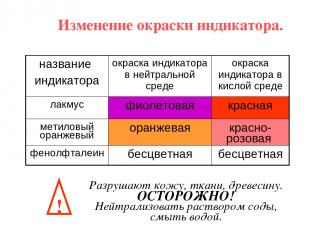
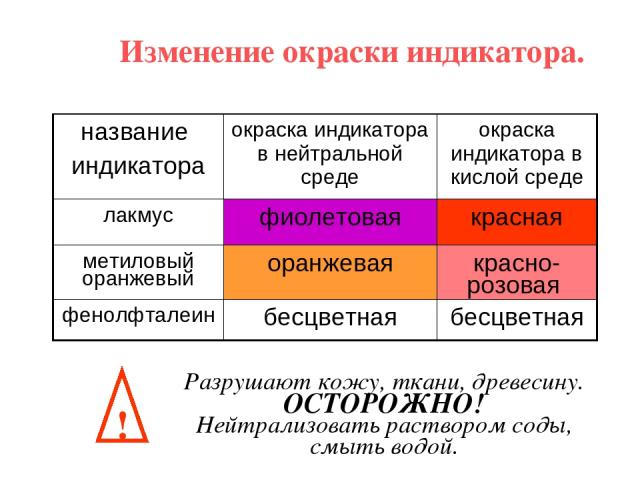
Изменение окраски индикатора. ! Разрушают кожу, ткани, древесину. ОСТОРОЖНО! Нейтрализовать раствором соды, смыть водой. название индикатора окраска индикатора в нейтральной среде окраска индикатора в кислой среде лакмус фиолетовая красная метиловый оранжевый оранжевая красно-розовая фенолфталеин бесцветная бесцветная
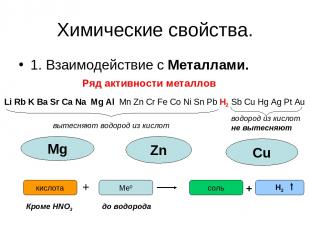
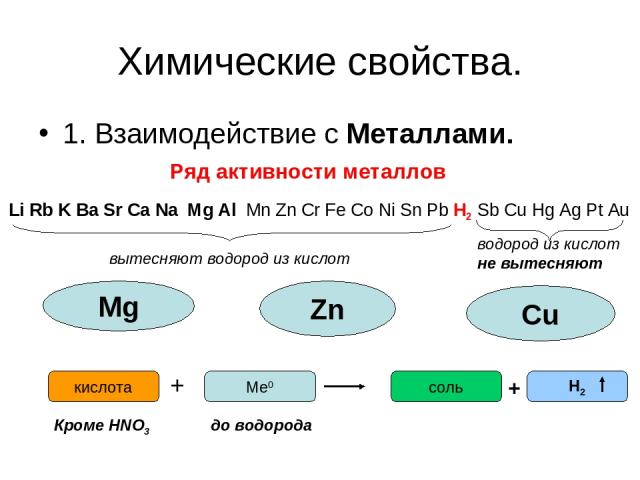
Химические свойства. 1. Взаимодействие с Металлами. Ряд активности металлов Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H2 Sb Cu Hg Ag Pt Au вытесняют водород из кислот водород из кислот не вытесняют Mg Zn Сu Ме0 + кислота соль Н2 + до водорода Кроме HNO3

Русский химик, академик Петербургской Академии наук. Основоположник физической химии. В 1863 г. составил вытеснительный ряд металлов, который называется по имени ученого.
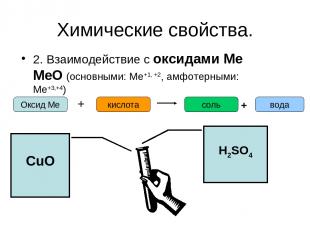
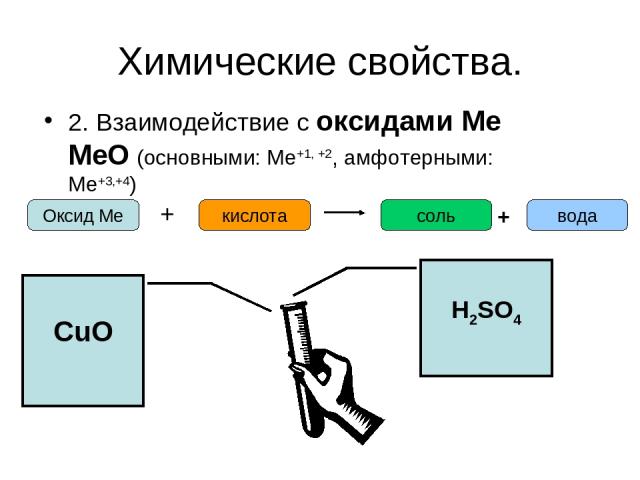
Химические свойства. 2. Взаимодействие с оксидами Ме МеО (основными: Ме+1, +2, амфотерными: Ме+3,+4) Оксид Ме + кислота соль вода + CuO H2SO4

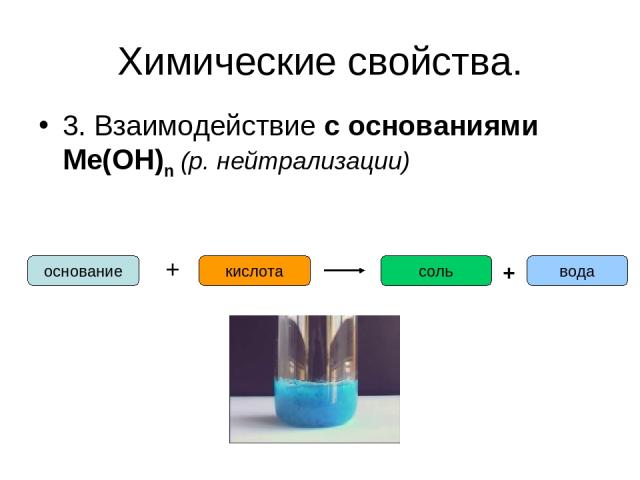
Химические свойства. 3. Взаимодействие с основаниями Ме(ОН)n (р. нейтрализации) основание + кислота соль вода +

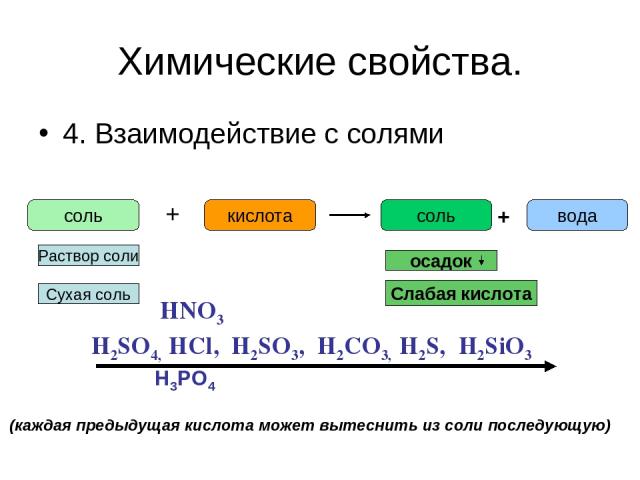
Химические свойства. 4. Взаимодействие с солями соль + кислота соль вода + H2SO4, HCl, H2SO3, H2CO3, H2S, H2SiO3 HNO3 H3PO4 (каждая предыдущая кислота может вытеснить из соли последующую) Раствор соли осадок Сухая соль Слабая кислота
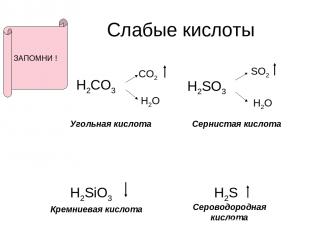
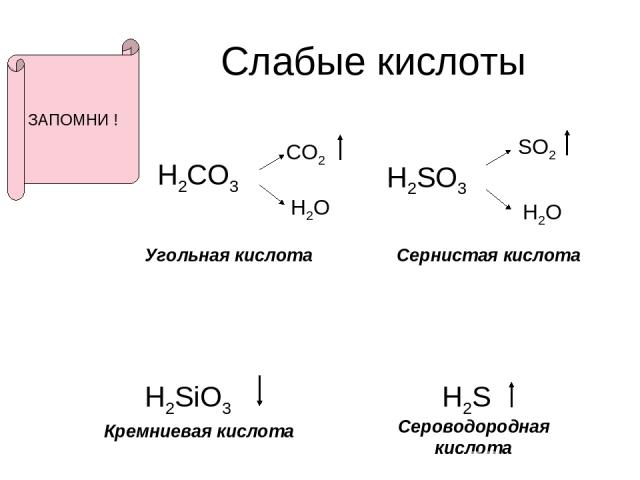
Слабые кислоты H2CO3 CO2 H2O H2SO3 SO2 H2O H2SiO3 H2S Угольная кислота Сернистая кислота Кремниевая кислота Сероводородная кислота ЗАПОМНИ !
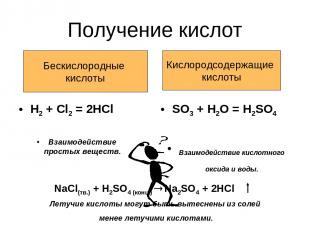
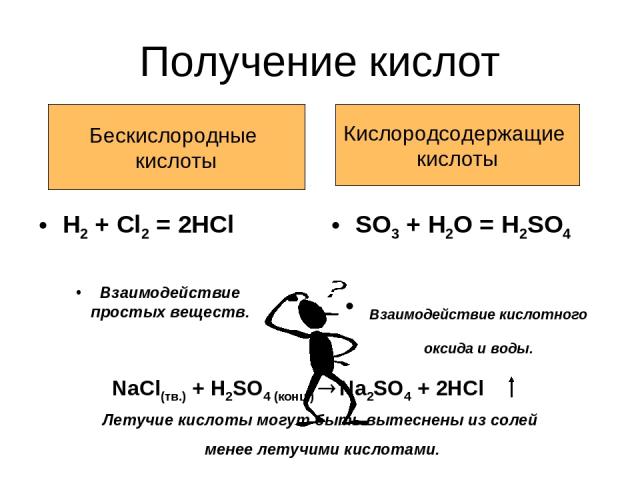
Получение кислот H2 + Cl2 = 2HCl Взаимодействие простых веществ. SO3 + H2O = H2SO4 Взаимодействие кислотного оксида и воды. Бескислородные кислоты Кислородсодержащие кислоты NaCl(тв.) + H2SO4 (конц.) Na2SO4 + 2HCl Летучие кислоты могут быть вытеснены из солей менее летучими кислотами.