Презентация на тему: Вещество

Как прекрасен этот мир, посмотри… 900igr.net

Человек связан с окружающим его миром живой и неживой природы тысячами незримых нитей. Он и сам является ее частью. Природа кормит, поит человека, обеспечивает его повседневные потребности, дарит несказанное удовольствие от общения с ней. Однако взаимоотношения человека с окружающей средой складываются очень непросто. С одной стороны, человек благоговеет перед природой, восторгается ею, воспевает ее в стихах, запечатлевает в прекрасных картинах и фотографиях

С другой стороны, человек вырубает леса, истребляет животных, загрязняет окружающий мир промышленными и бытовыми отходами, превращает прекрасные и полноводные реки в сточные канавы.

Терпеливая и мудрая природа в ответ наказывает человека землетрясениями и цунами, наводнениями и снежными лавинами, непредсказуемыми сменами климата и погоды

Чтобы взаимоотношения человека и окружающего его мира были добрыми и гармоничными, необходимо знать и понимать природу, бережно к ней относиться, разумно и грамотно вести хозяйственную деятельность. Этому призваны способствовать и изучаемые в школе предметы, которые относятся к естествознанию: биология, физика и химия. Химия – это наука о веществах, их строении, свойствах и превращениях веществ

Вещества и смеси. Классификация веществ Цель урока Сравнивая предметы и явления, выделить частные и общие, существенные и несущественные признаки, в процессе сравнения проникнуть в сущность объектов, без посторонней помощи заметить неощутимые с первого взгляда свойства, постигнуть особенности веществ

Планируемые результаты обучения * Знать определение предмета химии *Уметь различать вещества и физические тела *Знать отличие чистого вещества от смеси, основные способы разделения смесей *Знать правила обращения с необходимым для работы лабораторным оборудованием *Уметь изготавливать фильтр, фильтровать и выпаривать

Упоминание о веществах мы встречаем повсюду, даже в стихах… Железо, злато, медь, свинцова крепка сила И тягость серебра тогда себя открыла... М.В.Ломоносов Не жажду горы серебра, не знаю завтра, ни вчера, Доволен скромною судьбою и думаю: «К чему певцам алмазы, яхонты, топазы, Порфирные пустые вазы... Янтарь на трубках Цареграда, Фарфор и бронза на столе и чувств изнеженных отрада Духи в граненом хрустале… А.С.Пушкин

В синем небе, колокольнями проколотом, – Медный колокол, медный колокол – То ль возрадовался, то ли осерчал... Купола в России кроют чистым золотом, Чтобы чаще Господь замечал... В.Высоцкий Видели ли вы вещества и знаете ли, чем они отличаются друг от друга?

В этих стихах говорится о железе, золоте, меди, свинце и серебре, об алмазах, яхонтах, топазах и порфире. Все это – вещества. Посмотрите в окно, в нем стекло. Это тоже вещество, а за окном наша земная атмосфера – воздух, состоящий из кислорода, азота, углекислого газа и других веществ. По небу плывут облака – это водяной пар, вода тоже вещество.

А если облаков нет, а светит Солнце? Но и Солнце состоит из веществ, которые так сильно раскалены, что даже на расстоянии в 150 млн. километров оно нас согревает. Оно посылает на Землю столько энергии, сколько не вырабатывают все имеющиеся на Земле электростанции. Это именно благодаря Солнцу могут существовать на Земле животные и растения, но и они состоят из веществ.

Изучая физику, вы узнали, что мир, в котором мы живем, представляет собой мир физических тел и сред. Чем физическое тело отличается? Любое физическое тело имеет форму и объем. Физические тела – любые предметы, имеющие форму и объем

Физическими телами являются самые разнообразные предметы. Из своего жизненного опыта вы знаете, все, что нас с вами окружает, из чего-то состоит. Если вы заглянете в сахарницу или солонку, то увидите, что сахар и соль состоят из довольно мелких крупинок. А если посмотреть на эти крупинки через увеличительное стекло, то можно разглядеть, что каждая из них представляет собой многогранник с плоскими гранями (кристаллик). Без специальной аппаратуры нам не удастся различить, из чего состоят эти кристаллики, но современной науке хорошо известны методы, позволяющие это сделать.

Эти методы и приборы, их использующие, разработаны физиками. В них используются очень сложные явления, которые мы не будем здесь рассматривать. Скажем только, что эти методы можно уподобить очень сильному микроскопу. Если рассматривать в такой " микроскоп" кристаллик соли или сахара все с большим и большим увеличением, то, в конце концов, мы обнаружим что в состав этого кристаллика входят очень маленькие частички шарообразной формы. Обычно их называют атомы (хотя это не совсем верно, более точное их название – нуклиды). Атомы входят в состав всех окружающих нас тел и сред

Атомы – очень маленькие частицы, их размер лежит в пределах от одного до пяти ангстрем (обозначается – Аo.). Один ангстрем – это 10–10 м. Размер кристаллика сахара приблизительно 1 мм, такой кристаллик больше любого из входящих в его состав атомов примерно в 10 миллионов раз. Чтобы лучше представить себе, насколько маленькими частичками являются атомы, рассмотрим такой пример: если яблоко увеличить до размеров земного шара, то атом, увеличенный во столько же раз, станет размером со среднее яблоко. Несмотря на столь малые размеры, атомы представляют собой довольно сложные частицы. Со строением атомов вы познакомитесь в этом году.

В настоящее время известно чуть более ста видов атомов. Одной из важнейших особенностей атомов является их склонность соединяться друг с другом. Чаще всего при этом образуются молекулы. Молекулы – обособленные группы связанных друг с другом атомов. Молекула может содержать от двух до нескольких сотен тысяч атомов. При этом маленькие молекулы (двухатомные, трехатомные...) могут состоять и из одинаковых атомов, а большие, как правило, состоят из разных атомов.

Связи между атомами называются химическими связями, а связи между молекулами – межмолекулярными связями. Связанные между собой молекулы образуют вещества. Вещества – то, из чего состоят физические тела. Молекулярное вещество – вещество, состоящее из молекул. Немолекулярное вещество-– вещество, состоящее не из молекул.

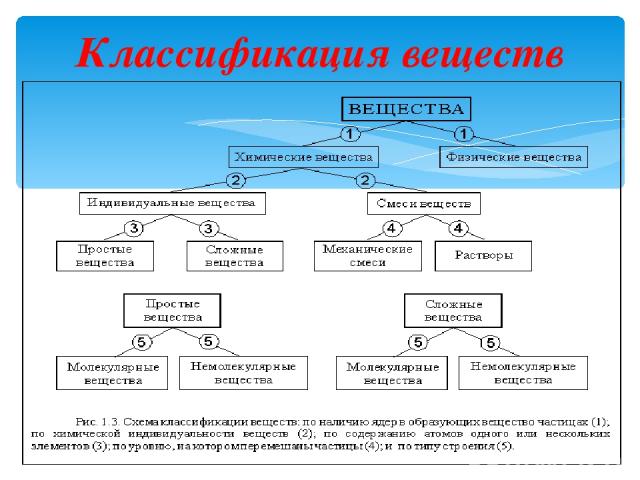
Первый классификационный признак – наличие (или отсутствие) в этих частицах атомных ядер. По этому признаку все вещества делятся на химические вещества и физические вещества. Химическое вещество – вещество, состоящее из частиц, содержащих атомные ядра. Такими частицами (а их называют химическими частицами) могут быть атомы (частицы с одним ядром), молекулы (частицы с несколькими ядрами), немолекулярные кристаллы (частицы с множеством ядер) и некоторые другие. Любая химическая частица, помимо ядер или ядра, содержит еще и электроны.

Кроме химических веществ, в природе существуют и другие вещества. Например: вещество нейтронных звезд, состоящее из частиц, называемых нейтронами; потоки электронов, нейтронов и других частиц. Такие вещества называют физическими. Физическое вещество – вещество, состоящее из частиц, не содержащих атомные ядра. На Земле с физическими веществами вы практически никогда не сталкиваетесь. По типу химических частиц или по типу строения все химические вещества делятся на молекулярные и немолекулярные, это вы уже знаете. Вещество может состоять из одинаковых по составу и строению химических частиц – в этом случае его называют чистым, или индивидуальным, веществом. Если же частицы разные, то – смесью.
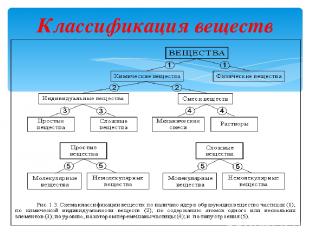
Классификация веществ

Каждое вещество индивидуально и неповторимо по своим признакам – свойствам: агрегатному состоянию, плотности, цвету, блеску, запаху, вкусу, твердости, пластичности, растворимости в воде, способности проводить тепло и электрический ток. Знание свойств веществ необходимо для их практического применения.

На уроках химии мы с вами будем изучать вещества Как же можно изучать вещества? Изучить вещество – это значит определить его свойства, которые устанавливаются только опытным путем. Некоторые из них можно установить с помощью наших органов чувств

Опыты по изучению физических свойств веществ ОПЫТ 1. Вещество и тело Разложите на столе две группы предметов: 1) стеклянная трубка, медная трубка, стальная трубка, резиновая трубка, пластмассовая трубка и другие трубки из различных веществ; 2) стеклянный стакан, стеклянная трубка, стеклянная пластинка, стеклянная колба и другие предметы из стекла. Рассмотрите и назовите каждый предмет и вещество, из которого состоит предмет. Дайте развернутый ответ на вопрос «Чем отличается понятие “тело” от понятия “вещество?».

ОПЫТ 2. Определение свойств вещества с помощью органов чувств Оборудование и реактивы. Вода, ледяная уксусная кислота, сера, сахар, клетчатка (вата), крахмал, цинк, медь, ванилин, аммиак (2–3 капли 25% раствора в плотно закрытой колбе), древесные лучинки, полиэтиленовая пленка и другие вещества, изделия из различных веществ. Рассмотрите вещества и изделия, определите их агрегатные состояния и внешние признаки. Внимание! Определение запаха и проба вещества на ощупь проводятся строго по указанию учителя с соблюдением всех правил техники безопасности. Определение вкуса веществ в лаборатории (школьном кабинете химии) категорически запрещается! Ваши наблюдения занесите в табл. 1.

Таблица 1 Особенные свойства веществ Свойство Вещество Название Название Название Название Название Агрегатное состояние Цвет Запах Звук при ударе Звук при разламывании Проба на ощупь

Для того, чтобы установить, какой вкус имеет вещество, его придется взять в рот, а этого делать нельзя, т. к. большинство веществ в химической лаборатории ядовиты. Известный шведский химик Карл Вильгельм Шееле (1742–1786) славился своей дурной привычкой пробовать на вкус всякое новое, полученное им вещество. Он открыл много веществ, последним из которых был цианистый калий (одно из известных очень ядовитых веществ). По всей видимости, он его попробовал, отчего и умер в 44 года. Находясь в химической лаборатории, даже пищевые продукты категорически запрещено есть, потому что на них могут случайно попасть ядовитые вещества с лабораторных столов!!!

Все мы знаем, что человека из обморочного состояния выводят, поднося к его носу вату, смоченную нашатырным спиртом. Нашатырным спиртом в медицине называют раствор в воде газа аммиака. Если раствор содержит много аммиака, то нюхать его долго опасно. По этой причине, если хотят понюхать неизвестное вещество, то делают это с предосторожностями: откупоренный сосуд с веществом отодвигают от лица на расстояние ~30 см и взмахами ладони направляют к себе его пары. В этом случае до носа доходит только небольшая часть паров вещества, и это безопасно.

Опыты по определению физических свойств веществ специальными методами Оборудование и реактивы. Нагревательные приборы, термометр (от 10 до 150 °С), весы, прибор для определения электропроводности, ареометры, цилиндры, колбы, пробирки, стеклянные палочки, гайки из различных сплавов массой 50–100 г, нитки, лед, вода, раствор поваренной соли (20–30%), мел, медная проволока, медный купорос, растительное масло. ОПЫТ 3. Температура плавления вещества Поместите в колбу несколько кусочков льда, закройте колбу пробкой со вставленным в нее термометром и отметьте температуру плавления льда (замерзания воды). ОПЫТ 4. Температура кипения вещества Налейте в колбу 50–60 мл воды, закройте колбу пробкой с термометром и газоотводной трубкой, нагрейте до кипения и отметьте температуру кипящей воды.

Опыты по определению физических свойств веществ специальными методами ОПЫТ 5. Определение плотности жидкости Налейте в один цилиндр воду, в другой – раствор поваренной соли и определите с помощью ареометра значения плотностей этих жидкостей. ОПЫТ 6. Определение плотности твердых тел Определите на весах массу (в граммах) гайки и привяжите к ней нить длиной 40–50 см. В мерный цилиндр налейте определенный объем воды, опустите в воду гайку и по разнице объемов жидкости в цилиндре установите объем (в миллилитрах) гайки. На основе полученных данных рассчитайте плотность (в г/см3) вещества, из которого сделана гайка, по формуле: плотность = масса/объем (г/см3). Полученный результат сравните со справочными данными по плотности различных металлов и сделайте вывод, из какого металла или сплава сделана взятая для эксперимента гайка.

Опыты по определению физических свойств веществ специальными методами ОПЫТ 7. Определение электропроводности веществ С помощью прибора по определению электропроводности веществ определите, проводят ли испытуемые вещества электрический ток (напряжение в сети не выше 36 В) ОПЫТ 8. Определение растворимости веществ Налейте в колбы по 20–30 мл воды и добавьте небольшие порции (1–2 г) медного купороса, мела и растительного масла. Перемешайте полученные смеси и запишите результаты о растворимости исследованных веществ. Для обобщения результатов всех проведенных измерений и исследований физических свойств веществ заполните табл. 2

Таблица 2 Физические свойства веществ Свойство Вещество Название Название Название Название Название Агрегатное состояние Цвет Запах Температура плавления, °С Температура кипения, °С Плотность, г/см3 Электропроводность (да, нет) Растворимость в воде (да, нет)

Опыты по изучению химических свойств веществ *Свойства веществ, проявляющиеся в процессе их превращения в другие вещества, называются химическими свойствами *Явления, которые при этом происходят, называются химическими явлениями *Химические свойства веществ также определяются с помощью специальных методов, простейшие из которых – нагревание и приведение веществ в непосредственное соприкосновение друг с другом

Опыты по изучению химических свойств веществ Оборудование и реактивы. Штатив, горелка, стаканы, пробирки, древесные лучинки; вода, мел или мрамор, раствор соляной кислоты, раствор нитрата серебра, железная, медная и алюминиевая проволока. ОПЫТЫ 1–4. Вещества горючие и негорючие Подожгите лучинку в пламени горелки. Отметьте ваши наблюдения, сделайте предположения о превращении вещества лучинки в процессе ее горения. Погасите лучинку, опустив ее в стакан с водой. Внесите в пламя горелки с помощью пинцета небольшие отрезки железной, медной и алюминиевой проволоки. Обратите внимание, что эти вещества не горят, но медная проволока покрывается черным налетом, а образец алюминия плавится.

Опыты по изучению химических свойств веществ ОПЫТ 5. Разложение древесины Поместите несколько тонких лучинок в пробирку, закрепите ее почти в горизонтальном положении с наклоном отверстия вниз, подставьте под отверстие стакан и сильно нагрейте содержимое пробирки. Наблюдайте образование ряда новых веществ в различных агрегатных состояниях. ОПЫТ 6. Мрамор превращается в газ Поместите кусочек мела или мрамора в пробирку и прилейте 2–3 мл раствора соляной кислоты. Наблюдайте выделение нового вещества – углекислого газа и исчезновение исходного вещества.

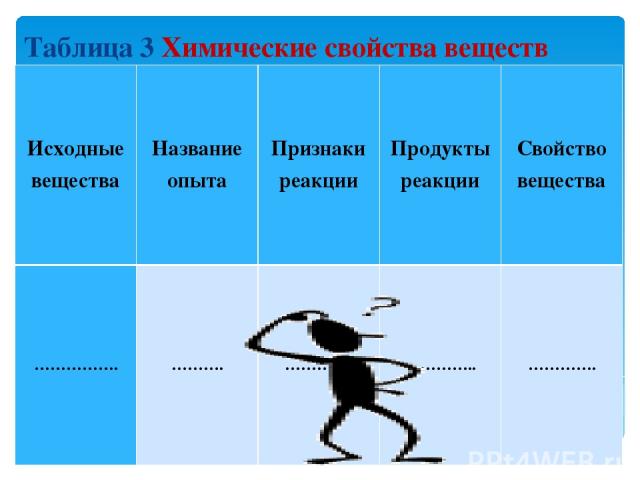
Опыты по изучению химических свойств веществ ОПЫТ 7. Образование нерастворимых веществ В пробирку с раствором соляной кислоты объемом 2–3 мл добавьте несколько капель раствора нитрата серебра. Наблюдайте образование нового вещества в виде белого творожистого осадка (нерастворимого в воде хлорида серебра). ОПЫТ 8. Из белого вещества – черное Осадок, полученный в опыте 7, выставьте на яркий свет. Наблюдайте потемнение вещества (образование серебра). Результаты опытов 1–8 занесите в табл. 3, указав в ней: исходные вещества, название опыта, внешние признаки, продукты реакции, химическое свойство вещества (горючесть, разложение при нагревании, реакция с кислотой, реакция с нитратом серебра, разложение под действием света).

Таблица 3 Химические свойства веществ Исходные вещества Название опыта Признаки реакции Продукты реакции Свойство вещества ……………. ………. …………. ………….. ………….

Описать вещество – это значит перечислить его свойства План описания свойств вещества: • название; • агрегатное состояние; • цвет, запах (вкус) и другие внешние признаки; • нахождение в природе; • плотность; • температура плавления (замерзания); • температура кипения; • электропроводность; • горючесть (негорючесть); • изменения при нагревании; • значение для растений и животных (необходимо отметить губительно или безразлично); • значение для человека; • свойства, на которых основано применение

Разделение смесей и очистка веществ Один из самых любимых материалов скульпторов и архитекторов – мрамор. Окраска этой горной породы удивительно разнообразна: молочно-белая, серая, розоватая. Причудливый узор радует глаз. Мрамор послушен и податлив в руках мастера, он легко обрабатывается и прекрасно полируется до зеркального блеска. Мрамор – это минерал, материал, из которого можно изготовить облицовочную плитку, статую или колонну дворца. Плитка, статуя, колонна – это физические тела, изделия. А вот основу мрамора составляет вещество, которое называется карбонат кальция. То же вещество входит в состав других минералов – мела, известняка.

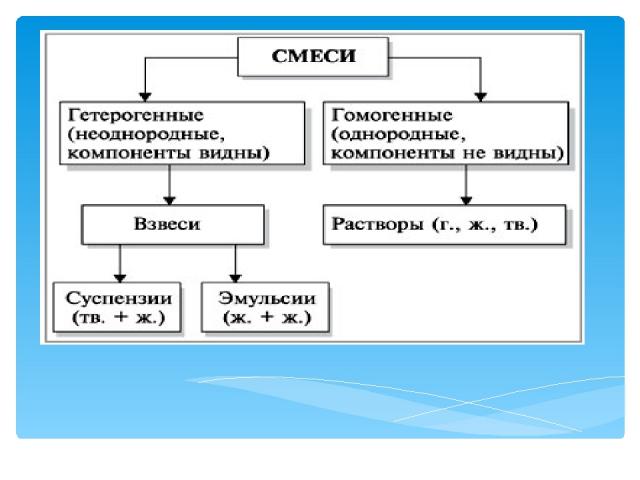
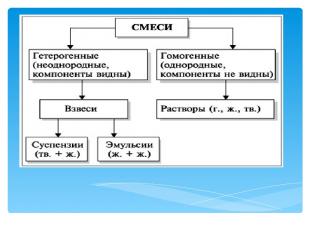
Разделение смесей и очистка веществ А теперь давайте подумаем, почему мрамор бывает разного цвета? Почему на его поверхности играет неповторимый узор? Потому, что помимо карбоната кальция в его состав входят примеси, придающие окраску. Аналогично и линейки бывают разного цвета, который зависит от того, какой краситель добавляют в пластмассу. В состав материала резины для изготовления автомобильных покрышек входит 24 компонента, важнейшим из которых является химическое вещество каучук. Вот и получается, что чистых веществ в природе, в технике, в быту очень немного. Гораздо чаще встречаются смеси – сочетание двух или более веществ. Воздух – это смесь различных газов; нефть – природная смесь органических веществ (углеводородов); любые минералы, горные породы – это тоже твердые смеси различных веществ.

Разделение смесей и очистка веществ В природе чистые вещества встречаются редко, чаще всего они входят в состав смесей. И в быту мы имеем дело в основном не с индивидуальными (отдельными) веществами, а со смесями или материалами сложного состава. Предметом же изучения науки химии является вещество и его превращения. Следовательно, одной из важнейших задач химии является получение индивидуальных (чистых) веществ. Эта проблема имеет два решения: • синтез веществ в лабораториях, на заводах, фабриках и комбинатах из других веществ и материалов; • разделение смесей (природных или искусственных) на отдельные компоненты – индивидуальные вещества.

Разделение смесей и очистка веществ *Постоянные физические свойства имеют только чистые вещества. Только чистая дистиллированная вода имеет tпл = 0 °С, tкип = 100 °С, не имеет вкуса. *Морская вода замерзает при более низкой, а закипает при более высокой температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более низкой, а закипает при более высокой температуре, чем вода Балтийского моря. *Почему? Дело в том, что в морской воде содержатся другие вещества, например растворенные соли, т.е. она представляет собой смесь различных веществ, состав которой меняется в широких пределах, свойства же смеси не являются постоянными. Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов»

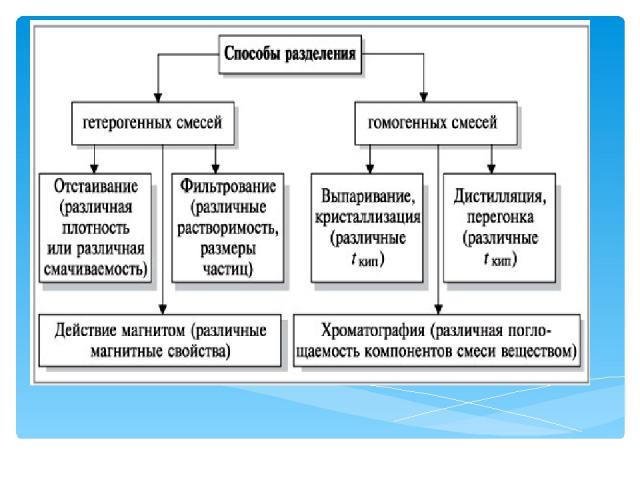
Опыты по разделению смесей и очистке веществ физическими методами Опыт 1. Вещества в смеси сохраняют свои индивидуальные свойства Оборудование и материалы. Магнит, ступка с пестиком, стаканы, бумага; вода, сера, железо (порошок). Проведение. Разотрите серу в ступке и высыпьте (2–3 г) на лист белой бумаги. На другой лист бумаги насыпьте порошок железа (2–3 г). Рассмотрите внешние признаки этих веществ. Здесь и далее в этом опыте обратите внимание на сходство и различие индивидуальных свойств железа и серы (агрегатное состояние, цвет, запах, растворимость в воде, смачиваемость водой, плотность, действие магнита и т.д.).

Опыты по разделению смесей и очистке веществ физическими методами Опыт 1. Вещества в смеси сохраняют свои индивидуальные свойства Проведение. Добавьте по щепотке серы и железа в стаканчики с водой. Накройте порции веществ на листках бумаги другими листками и прикоснитесь к ним сверху магнитом. Разотрите в ступке порошок железа (2 г) с серой (2 г) и рассмотрите смесь. Бросьте щепотку полученной смеси в стаканчик с водой. Другую порцию смеси насыпьте на лист бумаги, накройте другим листом и поднесите магнит.

Опыты по разделению смесей и очистке веществ физическими методами Опыт 1. Вещества в смеси сохраняют свои индивидуальные свойства Подробно опишите ваши наблюдения. Ответьте на вопросы. 1. Почему тонко измельченный порошок серы не тонет в воде? Обусловлено ли это свойство плотностью серы или здесь другая причина? 2. Какие свойства серы и железа вы установили в этом опыте? 3. Сохранились ли данные индивидуальные свойства компонентов в смеси? 4. Какие свойства серы и железа были использованы в этом опыте для разделения смеси железа с серой?

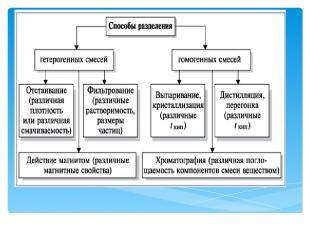
Опыты по разделению смесей и очистке веществ физическими методами Опыт 2. Неоднородные смеси можно разделить отстаиванием Оборудование и материалы Штатив, стаканы, цилиндры, делительные воронки; мутная (глина и песок) вода, смесь растительного масла и воды. Проведение. Взболтайте мутную воду в стакане и вылейте суспензию в цилиндр. Перемешайте тщательно смесь масла с водой и перелейте эмульсию в делительную воронку, закрепленную в штативе. Отметьте ваши наблюдения через 1, 2, 5 мин. Декантируйте жидкость из цилиндра в чистый стакан. Рассмотрите остаток в цилиндре и воду в стакане. Повернув кран делительной воронки, слейте из нее нижний слой жидкости в стакан.

Опыты по разделению смесей и очистке веществ физическими методами Опыт 2. Неоднородные смеси можно разделить отстаиванием 1. Какие свойства компонентов позволили разделить данные смеси? 2. Можно ли утверждать, что выделенные из смеси вещества (какие?) являются чистыми? 3. Приведите примеры разделения смесей методом отстаивания, применяемые на практике. На различии каких свойств веществ основан этот метод?

Опыты по разделению смесей и очистке веществ физическими методами Опыт 3. Суспензии можно разделить на компоненты фильтрованием Оборудование и материалы. Штатив с кольцом, воронка для фильтрования, стаканы, стеклянные палочки, фильтровальная бумага, вата, марля; мутная вода, 3%-й раствор сульфата меди(II). Проведение. Соберите установку для фильтрования и проведите фильтрование мутной воды сначала через слой марли, затем – ваты и, наконец, используя фильтровальную бумагу с достаточно мелкими порами. Аналогичный опыт проведите с раствором сульфата меди(II).

Опыты по разделению смесей и очистке веществ физическими методами Опыт 3. Суспензии можно разделить на компоненты фильтрованием Отметьте ваши наблюдения, сравните чистоту фильтрата при использовании различных фильтрующих материалов и применении различных методов для разделения смесей. Сделайте соответствующие выводы. 1. Можно ли разделить фильтрованием смесь воды и растительного масла или другие эмульсии? 2. Приведите примеры практического разделения смесей с помощью фильтрования. На чем основан этот метод разделения смесей? 3. Какие смеси можно разделить фильтрованием, а какие смеси невозможно разделить этим методом?

Опыты по разделению смесей и очистке веществ физическими методами Опыт 5. Флотация применяется для обогащения полезных ископаемых Оборудование и материалы. Высокий химический стакан, шпатель; смесь тонко измельченной серы с песком, вода. Проведение. С помощью шпателя подсыпайте небольшими порциями смесь серы с песком в стакан с водой, каждый раз хорошо перемешивая содержимое стакана. Опишите ваши наблюдения. Уточните по справочнику плотность песка, серы и воды и запишите их значения в тетрадь. 1. Заметили ли вы какие-либо противоречия между свойствами серы и плотностью этого вещества? 2. Приведите примеры практического применения флотации как метода разделения веществ при обогащении полезных ископаемых. На чем основан этот метод?

Опыты по разделению смесей и очистке веществ физическими методами Опыт 6. Можно ли выпариванием растворов получить соль и сахарный песок? Оборудование и материалы. Штатив с кольцом, сетка, фарфоровые чашки для выпаривания, спиртовка (горелка); 30%-й раствор поваренной соли, 40%-й раствор сахара. Проведение. Соберите установку для выпаривания. Налейте 3–4 мл раствора поваренной соли в чашку и проведите выпаривание жидкости почти досуха. Тигельными щипцами снимите чашку с огня и убедитесь, что вода полностью выпарилась. В противном случае осторожно доведите опыт до конца, не допуская излишнего перегрева соли. (О с т о р о ж н о! Возможно разбрызгивание горячего концентрированного раствора.) После того как чашка с солью остынет, соберите сухой остаток на чистый лист бумаги. Аналогично (о с т о р о ж но!) проведите выпаривание 3–4 мл раствора сахара. Попытайтесь и в этом случае собрать сухой остаток.

Опыты по разделению смесей и очистке веществ физическими методами Опыт 6. Можно ли выпариванием растворов получить соль и сахарный песок? Опишите ваши наблюдения и сравните результаты выпаривания растворов поваренной соли и сахара. Обратите внимание на внешний вид полученных веществ. П о м н и т е, что пробовать вещества на вкус в лаборатории категорически запрещается! 1. Все ли твердые вещества, растворенные в воде, можно получить в чистом виде путем выпаривания раствора при обычных условиях? 2. Приведите примеры получения веществ в чистом виде методом выпаривания на практике. На чем основан этот метод?

Опыты по разделению смесей и очистке веществ физическими методами Опыт 7. Красивые кристаллы можно «вырастить» дома Оборудование и материалы. Стаканы, нагревательный прибор, капроновая нить, стеклянная палочка; медный купорос, поваренная соль и другие соли, вода. Проведение. Приготовьте 250–300 мл насыщенного при 30 °С раствора cоли (из имеющейся в наличии). Если раствор содержит видимые примеси, профильтруйте его в большой стакан. К середине стеклянной палочки привяжите тонкую капроновую нить. Положите палочку на верх стакана, а свободный конец нити опустите в раствор почти до дна сосуда. Через 1–2 дня осмотрите нить и снимите с нее все кристаллики, кроме одного – самого крупного и самой правильной формы.

Опыты по разделению смесей и очистке веществ физическими методами Опыт 7. Красивые кристаллы можно «вырастить» дома Раствор можно вновь нагреть до растворения выпавших кристаллов и после охлаждения повторно опустить в него нить с кристаллом. Операцию проводят до получения крупного кристалла. Выращенные кристаллы лучше хранить в прозрачных закрытых сосудах, снабдив их этикетками. Зарисуйте полученные кристаллы, сравните формы крупных и мелких кристаллов одного и того же вещества и формы кристаллов различных веществ. Сделайте соответствующие выводы. Приведите примеры практического применения кристаллизации и перекристаллизации в качестве способа очистки веществ. На чем основан этот метод?

Опыты по разделению смесей и очистке веществ физическими методами Опыт 9. Растворимость йода в гексане выше, чем в воде Оборудование и материалы. Делительная воронка, стакан; йодная вода, гексан (можно взять неокрашенный бензин или керосин прямой перегонки). Проведение. Налейте в делительную воронку 5–10 мл йодной воды и осторожно по стенке сосуда добавьте 2–3 мл растворителя. Обратите внимание, что растворитель легче воды. Закройте воронку пробкой и осторожно, придерживая пробку, перемешайте смесь. Обратите внимание, что йод перешел из водного слоя в слой растворителя.

Опыты по разделению смесей и очистке веществ физическими методами Опыт 9. Растворимость йода в гексане выше, чем в воде Опишите ваши наблюдения, сравните окраски исходных и полученных растворов. Объясните эти изменения. По словарю найдите толкование понятия «экстракция». Приведите примеры практического применения экстракции как способа очистки и выделения веществ. На чем основан этот метод?

ОЦЕНИВАНИЕ УЧЕБНЫХ ДОСТИЖЕНИЙ Критерии для оценивания практических и лабораторных работ Критерий С. Научное знание и понимание Критерий D: Научноe исследованиe Критерий E. Обработка информации Критерий F. Проведение эксперимента
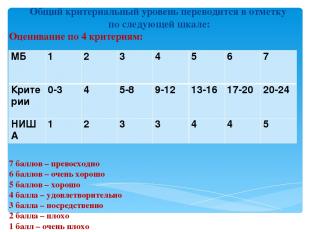
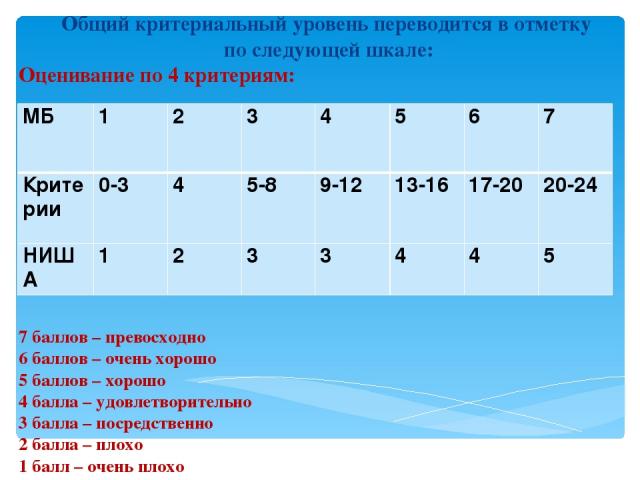
Общий критериальный уровень переводится в отметку по следующей шкале: Оценивание по 4 критериям: 7 баллов – превосходно 6 баллов – очень хорошо 5 баллов – хорошо 4 балла – удовлетворительно 3 балла – посредственно 2 балла – плохо 1 балл – очень плохо MБ 1 2 3 4 5 6 7 Критерии 0-3 4 5-8 9-12 13-16 17-20 20-24 НИША 1 2 3 3 4 4 5

Прием “Кластер” для рефлексии Разбивка на кластеры очень проста и легко запоминается: 1. Напишите ключевое слово или предложение в середине листа или доски. 2. Далее запишите слова или предложения, которые приходят на ум в связи с данной темой. 3. По мере того как возникают идеи необходимо установить связи между ними, обозначив их черточками.

Домашнее задание Приложение к уроку №1 Выращивание кристаллов соли (домашний эксперимент) Приложение к уроку №2 Для любознательных(материал для чтения) Чистые вещества и смеси Приложение к уроку №3 Самостоятельная работа (для проверки знаний)

Л и т е р а т у р а Аликберова Л.Ю. Занимательная химия. М.: АСТ-Пресс, 1999; Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 8 класс. М.: Дрофа, 2002; Габриелян О.С. Химия.8 класс. М.: Дрофа, 2000; Гузей Л.С., Сорокин В.В., Суровцева Р.П. Химия. 8 класс. М.: Дрофа, 1995; Ильф И.А., Петров Е.П. Двенадцать стульев. М.: Просвещение, 1987; Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия. Учебник для учащихся 8 класса общеобразовательных учреждений. М.: Вентана-Граф, 1997; Рудзитис Г.Е., Фельдман Ф.Г. Химия. Учебник для 8 класса общеобразовательных учреждений. М.: Просвещение, 2000; Тыльдсепп А.А., Корк В.А. Мы изучаем химию. М.: Просвещение, 1998. Г. Штремплер. "Учебный эксперимент в начале курса химии. Разделение смесей и очистка веществ" (N20/2007)

Интернет ресурсы school-sector.relarn.ru - "Химия для ВСЕХ" из серии "Обучающие энциклопедии". Сайт содержит текстовые и графические материалы ( school-sector.relarn.ru ) размещенные во 2-м издании CDROM "Химия для ВСЕХ" 1999г. Это большой и хороший учебник химии. Разделы: Общая химия, Неорганическая химия, Органическая химия. В разделе "Обучающие программы" school-sector.relarn.ru можноскачать все текстовые материалы сайта "Химия для всех" (все - 1,13Мб, или отдельные части) Все эти материалы размещены и по адресу -informika.ru ● chem.msu.su - "Экспериментальный учебник химии для 8-го и 9-го классов" Жуков С.Т. и его продолжение chem.msu.su - "Экспериментальный учебник химии для 10-го и 11-го классов" (Из рецензии к учебнику: "Эти учебные пособия можно назвать уникальными. Строгая система определений сочетается в них с научной строгостью изложения. Пособия очень хороши для учащихся 11-х классов, повторяющих химию накануне выпускных и вступительных экзаменов (к тестовому Единому государственному экзамену это не относится, для него учебники слишком "умные".)

Интернет ресурсы ● chem.msu.su - небольшой электронный учебник "Трудные темы школьного курса химии" В.В. Загорский. (в первую очередь для учителей химии) ● alhimikov.net - сайт "alhimikov.net". Содержание: электронный учебник "Основы общей и неорганической химии" для 8-9 кл.; Химические таблицы; Скачать периодическую систему и программу PL Table 4.2 а также смотреть на сайте "Химические элементы" - это периодическая таблица с подробным описанием всех элементов; Классификация веществ, реакций; в разделе "Тесты" можно скачать программу Универсальный тест 3.0.0.4 - 9,5 Мб; Уроки; Решение задач и мн. др.

Интернет ресурсы ● alhimik.ru - "Алхимик" Советы абитуриенту. Учителю химии. Справочник alhimik.ru (очень большая подборка таблиц и справочных материалов). Веселая химия. Новости, Олимпиады, Кунсткамера (масса интересных исторических сведений) и др. В частности, в читальном зале alhimik.ru есть книжка alhimik.ru - "Химия для любознательных. Основы химии и занимательные опыты" Гроссе Э., Вайсмантель Х. (пер. с немецкого). (А также много других интересных статей и книжек.). ● alhimik.ru - В разделе ЦУ: Типы и номенклатура неорганических веществ alhimik.ru ; Классификация и номенклатура органических веществ alhimik.ru ; Периодическая система элементов Менделеева и др., а также Электронные пособия (для высшей школы, но будут полезны и школьникам, желающим знать химию лучше): Строение вещества; Практикум по неорганической химии; Задачник по неорганической химии и др. ● alhimik.ru - "Веселая химия" Невероятные превращения веществ, с шумными фейерверками, неожиданными переливами цвета.

Ждем ваших вопросов и ответов Спасибо за внимание! До скорой встречи!