Презентация на тему: Угольная кислота

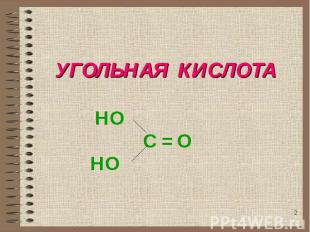
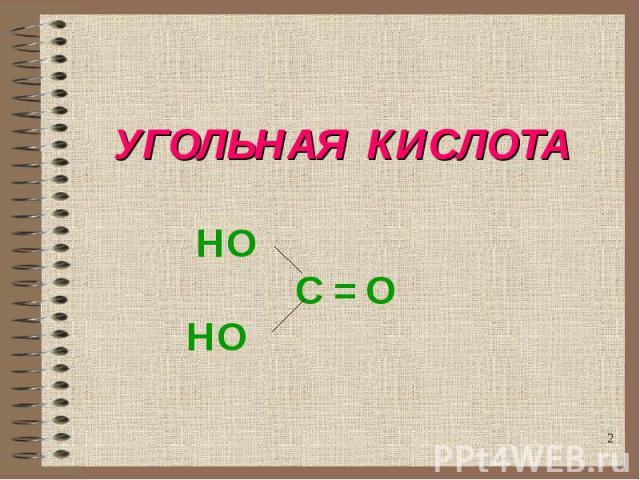
УГОЛЬНАЯ КИСЛОТА НО C = O НО

Гидроксимуравьиная (угольная) кислота и её производные
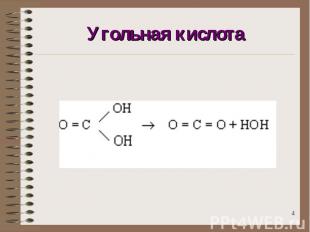
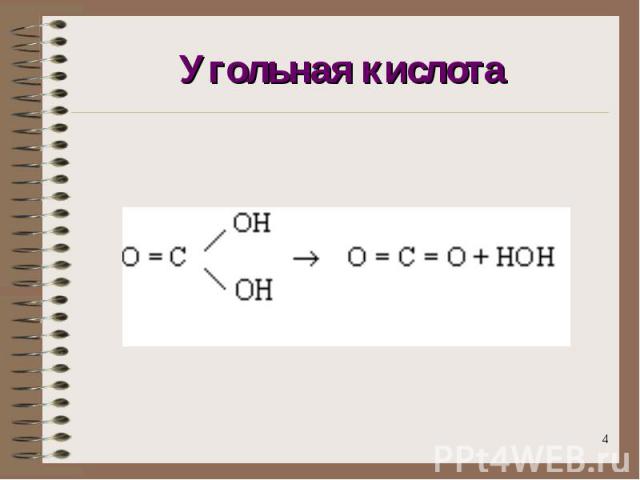
Угольная кислота

УГОЛЬНОЙ КИСЛОТЕСООТВЕТСТВУЮТ: МОНОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ (неустойчивые и легко разлагаются, например HCO2Cl ) ДИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ (устойчивые и находят практическое применение. К ним относят карбонаты, уретаны, галогенангидриды, амиды)

Многие производные угольной кислоты имеют важное практическое значение Фосген (карбонилхлорид) COCl2 – полный хлорангидрид угольной кислоты, который образуется при взаимодействии монооксида углерода с хлором на свету или при нагревании.

Карбаминовая кислота H2N - COOH – неполный амид угольной кислоты. ОНО = С NН2В свободном состоянии не существует, однако соли и эфиры этой кислоты достаточно устойчивы и находят практическое применение.
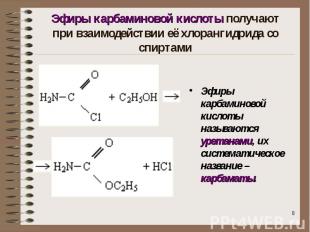
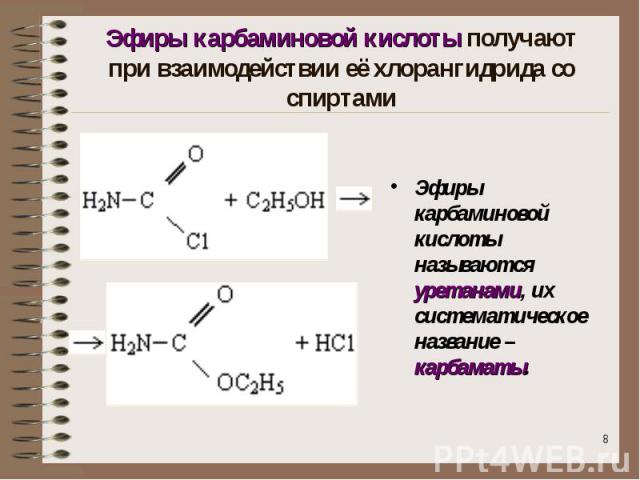
Эфиры карбаминовой кислоты получают при взаимодействии её хлорангидрида со спиртами Эфиры карбаминовой кислоты называются уретанами, их систематическое название – карбаматы.
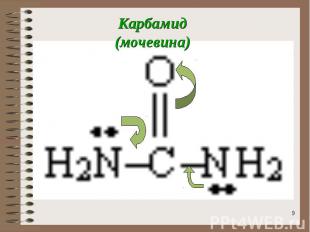
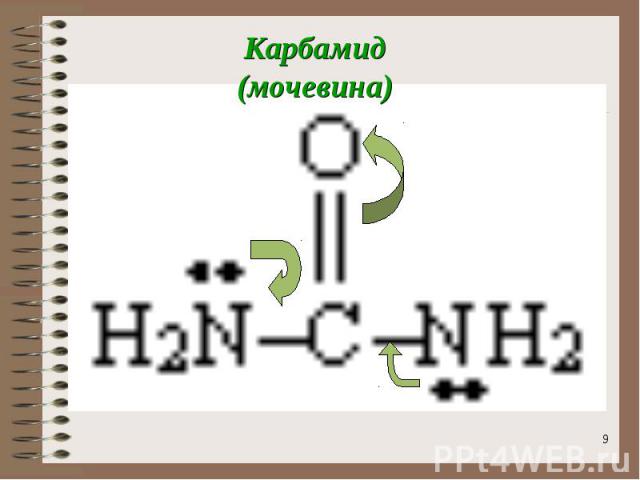
Карбамид (мочевина)

КАРБАМИД (МОЧЕВИНА)Представляет собой полный амид угольной кислоты: Н2N C = O Н2N белое кристаллическое вещество, хорошо растворимое в воде и этаноле
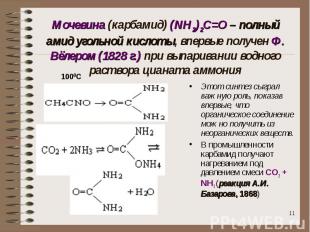
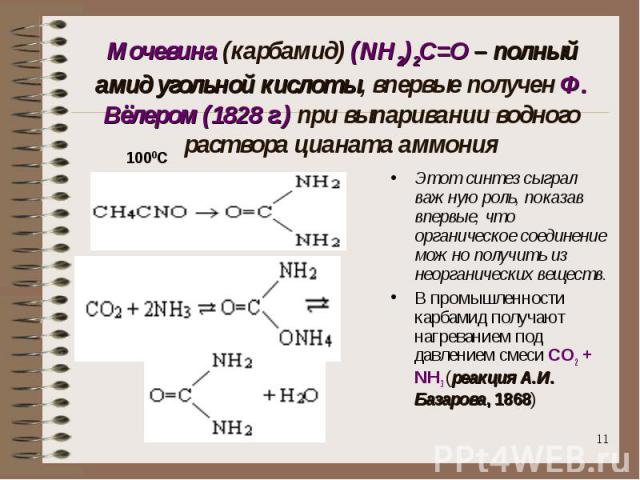
Мочевина (карбамид) (NH2)2C=O – полный амид угольной кислоты, впервые получен Ф. Вёлером (1828 г.) при выпаривании водного раствора цианата аммония Этот синтез сыграл важную роль, показав впервые, что органическое соединение можно получить из неорганических веществ.В промышленности карбамид получают нагреванием под давлением смеси CO2 + NH3 (реакция А.И. Базарова, 1868)

Для карбамида (мочевины) характерны следующие химические свойства: 1. Разложение азотистой кислотойПри действии азотистой кислоты карбамид разлагается с выделением азота
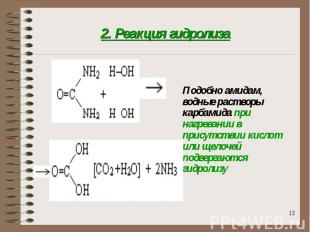
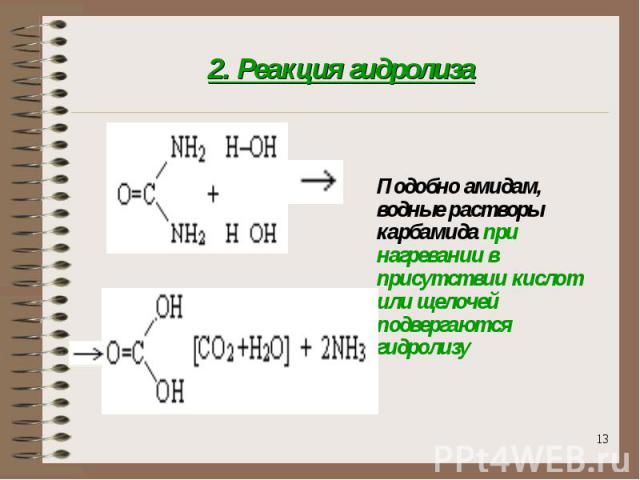
2. Реакция гидролиза Подобно амидам, водные растворы карбамида при нагревании в присутствии кислот или щелочей подвергаются гидролизу
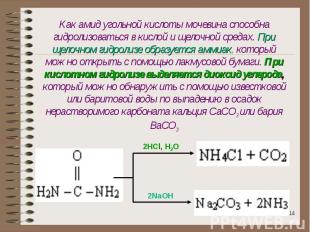
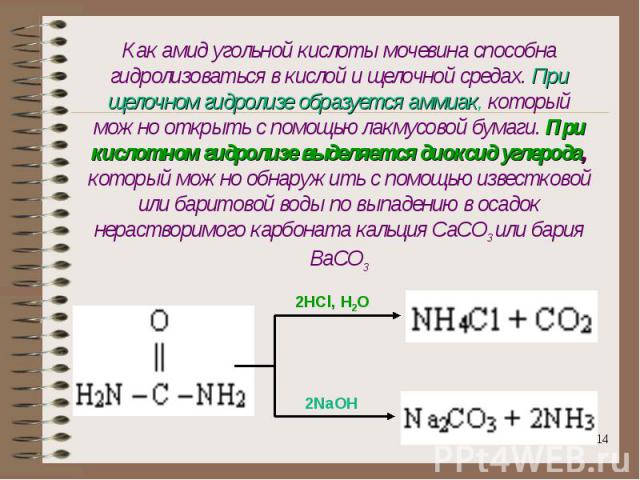
Как амид угольной кислоты мочевина способна гидролизоваться в кислой и щелочной средах. При щелочном гидролизе образуется аммиак, который можно открыть с помощью лакмусовой бумаги. При кислотном гидролизе выделяется диоксид углерода, который можно обнаружить с помощью известковой или баритовой воды по выпадению в осадок нерастворимого карбоната кальция CaCO3 или бария BaCO3

3. Разложение при нагревании При нагревании выше температуры плавления карбамид плавится, а затем разлагается с выделением аммиака и образованием твёрдого продукта - биурета
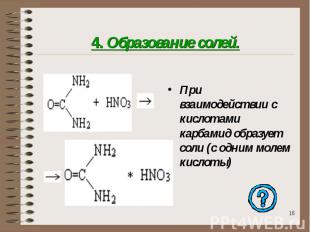
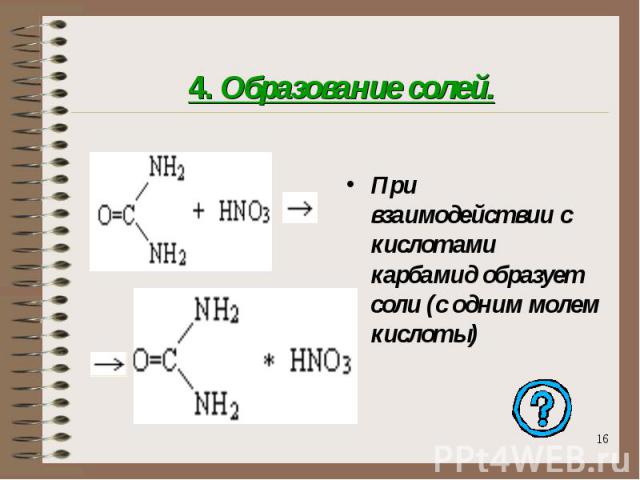
4. Образование солей. При взаимодействии с кислотами карбамид образует соли (с одним молем кислоты)

5. Алкилирование карбамида. При алкилировании образуются алкильные производные карбамида
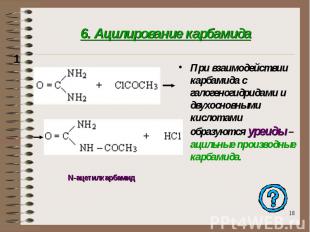
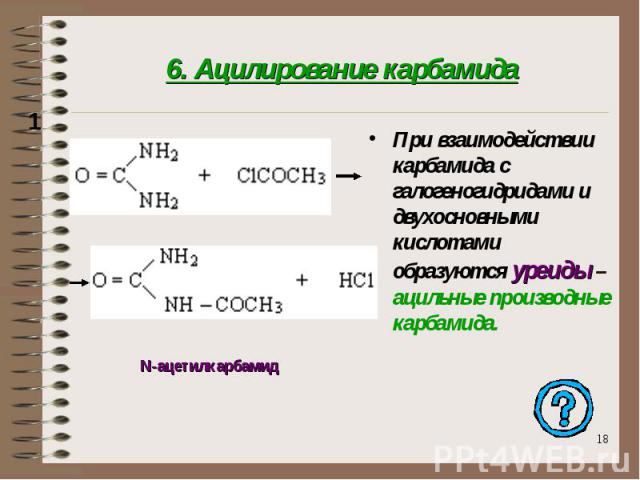
6. Ацилирование карбамида При взаимодействии карбамида с галогеногидридами и двухосновными кислотами образуются уреиды – ацильные производные карбамида.

7. Циклизация карбамида При нагревании (350-5000C) и давлении (10-40 МПа) шесьт молекул карбамида образуют циклическое соединение – меламин (1,2,4-триамино-1,3,5-триазин).* Меламин применяют для производствамеламиноальдегидных полимеров, лаков и клеев,обладающих высокой механической прочностью,водо- и термостойкостью. Используют в качестведубителя.

* Вычислите массовую долю (%) азота в карбамиде (мочевине). *Почему карбамид может служить ценным азотистым удобрением!

Решение задачи: 1. Рассчитаем молярную массу карбамида – (NH2)2 CO: М = 2 (14 + 2) + 12 + 16 = 60 г2. Вычислим массовую долю азота в мочевине: W = m / M = 28 / 60 = 0,466 или 46,6%

Задание для самостоятельной проработки темы В каждом тестовом задании выберите только один правильный ответ. Время работы – 5 минут.Критерии оценки:«5» - 9-10 правильных ответов;«4» - 7-8 правильных ответов; «3» - 5-6 правильных ответов. УДАЧИ ВАМ!

«Ключик» для химического хамелеона Из полученных ответов составьте словосочетание

Правильный ответ«Ключик» для химического хамелеона

Спасибо всем! Скажи мне – и я забуду,Покажи мне – и я запомню,Вовлеки меня – и я научусь! Китайская мудрость