Презентация на тему: Элементы IV группы главной подгруппы. Углерод

Элементы IV группы главной подгруппы.Углерод. План:1. Нахождение в природе.2. Электронное строение и положение в ПСХЭ.3. Методы получения: лабораторные и промышленные.4. Аллотропные видоизменения углерода.5. Химические свойства. Карбиды.6. Применение. Токсичность.7. Интересное об углероде.

Нахождение в природе. Среди множества химических элементов, без которых невозможно существование жизни на Земле, углерод является главным. Более 99% углерода в атмосфере содержится в виде углекислого газа. Около 97% углерода в океанах существует в растворённой форме ( ), а в литосфере - в виде минералов.Элементарный углерод присутствует в атмосфере в малых количествах в виде графита и алмаза, а в почве - в форме древесного угля.

Положение в ПСХЭ.Общая характеристика элементов подгруппы углерода. Главную подгруппу IV группы периодической системы Д. И. Менделеева образуют пять элементов - углерод, кремний, германий, олово и свинец. В связи с тем, что от углерода к свинцу радиус атома увеличивается, размеры атомов возрастают, способность к присоединению электронов, а, следовательно, и неметаллические свойства будут ослабевать, легкость же отдачи электронов - возрастать.

Электронное строение В нормальном состоянии элементы этой подгруппы проявляют валентность, равную 2. При переходе в возбуждённое состояние, сопровождающееся переходом одного из s – электронов внешнего слоя в свободную ячейку p – подуровня того же уровня, все электроны наружного слоя становятся не спаренными и валентность при этом возрастает до 4.

Методы получения: лабораторные и промышленные. УглеродНеполное сжигание метана: СН4 + О2 = С + 2Н2О Оксид углерода (II)В промышленности:Оксид углерода (II) получают в особых печах, называемых газогенераторами, в результате двух последовательно протекающих реакций. В нижней части газогенератора, где кислорода достаточно, происходит полное сгорание угля и образуется оксид углерода (IV): C + O2 = CO2 + 402 кДж.

По мере продвижения оксида углерода (IV) снизу вверх последний соприкасается с раскалённым углём: CO2 + C = CO – 175 кДж.Получающийся газ состоит из свободного азота и оксида углерода (II). Такая смесь называется генераторным газом. В газогенераторах иногда через раскалённый уголь продувают водяной пар:C + H2O = CO + H2 – Q, «CO + H2» - водяной газ.В лаборатории:Действуя на муравьиную кислоту концентрированной серной кислотой, которая связывает воду:HCOOH H2O + CO.

Оксид углерода (IV)В промышленности:Побочный продукт при производстве извести:CaCO3 CaO + CO2.В лаборатории:При взаимодействии кислот с мелом или мрамором:CaCO3 + 2HCl CaCl2 + CO2+ H2O. КарбидыКарбиды получают при помощи прокаливания металлов или их оксидов с углём.

Угольная кислотаПолучают растворением оксида углерода (IV) в воде. Так как угольная кислота очень не прочное соединение, то эта реакция обратима:CO2 + H2O H2CO3. КремнийВ промышленности:При нагревании смеси песка и угля:2C + SiO2 Si + 2CO.В лаборатории:При взаимодействии смеси чистого песка с порошком магния:2Mg + SiO2 2MgO + Si.

Кремниевая кислотаПолучают при действии кислот на растворы её солей. При этом она выпадает в виде студенистого осадка:Na2SiO3 + HCl 2NaCl + H2SiO32H+ + SiO32- H2SiO3

Аллотропные видоизменения углерода. Углерод существует в трех аллотропных модификациях: алмаз, графит и карбин.

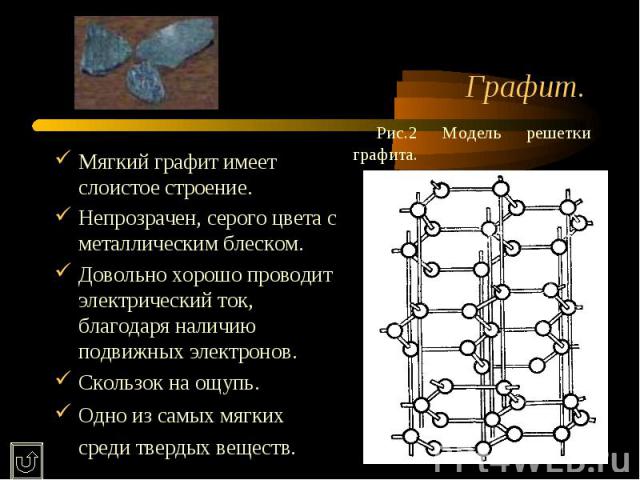
Графит. Рис.2 Модель решетки графита.Мягкий графит имеет слоистое строение. Непрозрачен, серого цвета с металлическим блеском.Довольно хорошо проводит электрический ток, благодаря наличию подвижных электронов. Скользок на ощупь.Одно из самых мягких среди твердых веществ.

Алмаз. Рис.1 Модель решетки алмаза.Алмаз - самое твердое природное вещество. Кристаллы алмазов высоко ценятся и как технический материал, и как драгоценное украшение. Хорошо отшлифованный алмаз - бриллиант. Преломляя лучи света, он сверкает чистыми, яркими цветами радуги.Самый крупный из когда-либо найденных алмазов весит 602 г, имеет длину 11 см, ширину 5 см, высоту 6 см. Этот алмаз был найден в 1905 г и носит имя «Кэллиан».

Карбин и Зеркальный углерод. Карбин представляет собой порошок глубокого черного цвета с вкраплением более крупных частиц.Карбин - самая термодинамически устойчивая форма элементарного углерода. Зеркальный углерод имеет слоистое строение. Одна из важнейших особенностей зеркального углерода (кроме твердости, стойкости к высоким температурам и т. д.) - его биологическая совместимость с живыми тканями.

Химические свойства. Щелочи переводят кремний в соли кремниевой кислоты с выделением водорода :Si + 2КОН + H2O= К2Si03 + 2Н2С водой углерод и кремний реагируют лишь при высоких температурах:С + Н2О ¬ СО + Н2Si + ЗН2О = Н2SiO3 + 2Н2Углерод в отличие от кремния непосредственно взаимодействует с водородом: С + 2Н2 = СН4

Карбиды. Соединения углерода с металлами и другими элементами, которые по отношению к углероду являются электроположительными, называются карбидами.При взаимодействии карбида алюминия с водой образуется метанAl4C3 + 12H2O = 4Al (OH)3 + 3CH4При взаимодействии с водой карбида кальция – ацетилен:CaC2 + 2H2O = Ca (OH)2 + C2H2

Применение. Углерод определяется тем, что свыше 90 % всех первичных источников потребляемой в мире энергии приходится на органическое топливо.Гидрокарбонат натрия продают в аптеках и продовольственных магазинах под названием питьевой соды.Питьевую соду применяют в кондитерском деле и хлебопечении.

Оксид углерода (IV) ü Получение сахара.ü Тушение пожаров.ü Производство фруктовых вод.ü «Сухой лёд».

Оксид кремния (IV) Силикатных кирпичи.Керамические изделия.Стекло.
Силикаты. Клей.

Интересный факт. Подземный углерод мог не раз вызвать массовое вымирание на планете и постоянно грозит разразиться новой катастрофой в любой момент.Одно из этих событий произошло 245 миллионов лет назад в конце Пермской эры, которая представляла собой самый трагический случай вымирания фауны в земной хронологии: ископаемые породы свидетельствуют о вымирании тогда около 96% всех морских обитателей. Возможно подобный же случай привел к началу вымирания динозавров задолго до катастрофы с падением астероида 65 миллионов лет.

КОНЕЦ.