Презентация на тему: Углерод и его соединения

Углерод и его соединения Лекция.(§29 -30, с.172 -178). Цель: Какие соединения образует углерод? Какие свойства, связанные со строением атома углерода, характерны для углерода и его соединений? Где находят применение соединения углерода? 900igr.net

Необходимо вспомнить. Положение химического элемента в таблице Д.И.Менделеева. Электронная формула атома углерода. Какие высшую и низшую степени окисления проявляет углерод в соединениях? Составьте формулы высшего оксида, соответствующего гидроксида, водородного соединения углерода. Расставьте в них степень окисления и определите заряды ионов в кислоте. Что такое аллотропия? С какими аллотропными модификациями мы встречались в курсе химии?

Нам известно, что Углерод – химический элемент с порядковым номером 6, расположен во 2 периоде, ΙVгруппе главной подгруппы. Электронная формула атома – 1s22s22p2. Высшая степень окисления - +4, низшая - -4. +4 -2 + +4 -2 -4 + СO2 , H2 + С O3 2-,, С H4 . Аллотропия – существование химического элемента в виде нескольких простых веществ. Кислород (О2) и озон (О3) являются аллотропными модификациями химического элемента кислорода, х.э. сера образует кристаллическую и пластическую серу, фосфор – белый и красный фосфор.

Составить конспект-ответ, придерживаясь следующих вопросов. Какова форма существования химического элемента углерода? Какого строение атома углерода? Какие аллотропные модификации образует углерод? Каковы их строение и свойства?(ответ оформите в виде таблицы). Какие химические свойства характерны для углерода? Какие физические и химические свойства проявляют соединения углерода: а) оксид углерода(II) и (V), б) угольная кислота, в)как их получают, (ответ оформите в виде таблицы). г)качественная реакция н а углекислый газ и карбонат-анион – СO32-? Каковы условия перехода карбонаты в гидрокарбонаты?

Соединения углерода. Заполните таблицу. ? Генетичекская взаимосвязь CO CO2 H2CO3 Карбонаты и гидрокарбонаты. Получение Физические свойства Химические свойства Применение

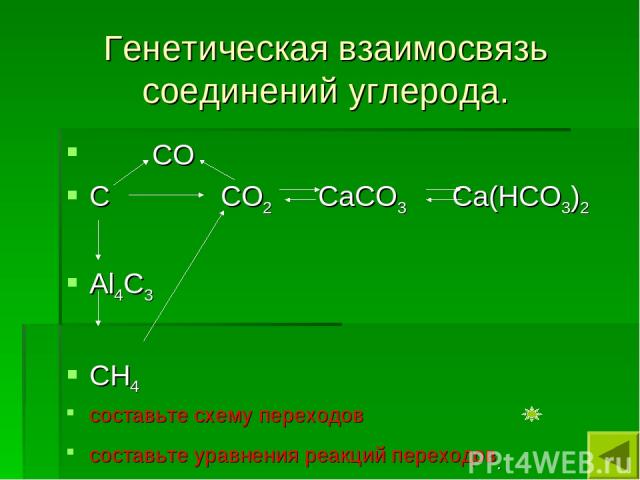
Генетическая взаимосвязь соединений углерода. СО С СО2 СаСО3 Са(НСО3)2 Аl4С3 СН4 составьте схему переходов составьте уравнения реакций переходов.
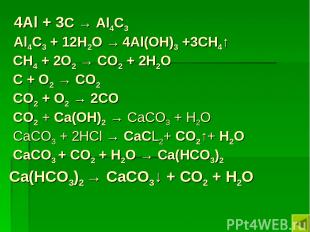
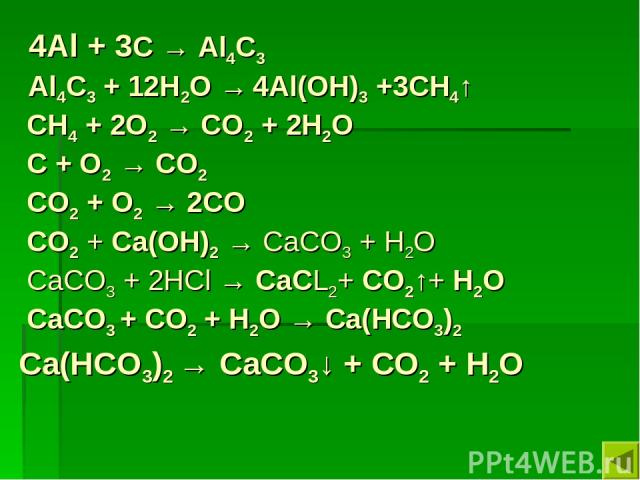
4Al + 3С → Al4С3 Al4С3 + 12H2O → 4Al(OH)3 +3CH4↑ CH4 + 2O2 → CO2 + 2H2O C + O2 → CO2 CO2 + O2 → 2CO СО2 + Са(ОН)2 → СаСО3 + Н2О СаСО3 + 2НCl → СаСL2+ СО2↑+ Н2О СаСО3 + СО2 + Н2О → Са(НСО3)2 Са(НСО3)2 → СаСО3↓ + СО2 + Н2О

1.Качественная реакция на СО32- = получение СО2 в лаборатории. 2.Качественная реакция на СО2. 1) СаСО3 + 2НCl → СаСL2 + СО2↑ + Н2О Составьте уравнение реакции получения углекислого газа в лаборатории, она же – качественная реакция на карбонат-анион. Как доказать, что выделяющийся газ – СО2? Составьте уравнение соответствующей реакции. 2) СО2 + Са(ОН)2 → СаСО3 + Н2О

Переход карбонаты в гидрокарбонаты и обратно. СаСО3 + СО2 + Н2О → Са(НСО3)2 t исчезновение помутнения Са(НСО3)2 → СаСО3↓ + СО2 + Н2О Составьте уравнения реакций перехода карбонатов в гидрокарбонаты и обратно.

Домашнее задание. Урок 1: §29, ?1,2,6,8. Урок 2: §30, ?1,3,6,7.