Презентация на тему: Углерод и его соединения

У меня достоинств много есть “Людям я совсем как брат. Много тысяч лет назад, Освещая интерьер Первобытных их пещер, Я уже пылал в костре. И украсить был я рад Дам и рыцарей наряд, Что блистали при дворе… Если мягким быть решу, То в тетради я пишу, Такова друзья природа Элемента…

УГЛЕРОД И ЕГО СОЕДИНЕНИЯ
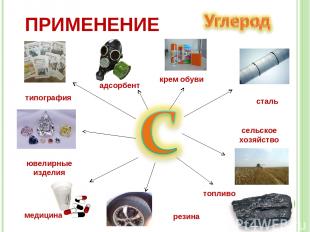
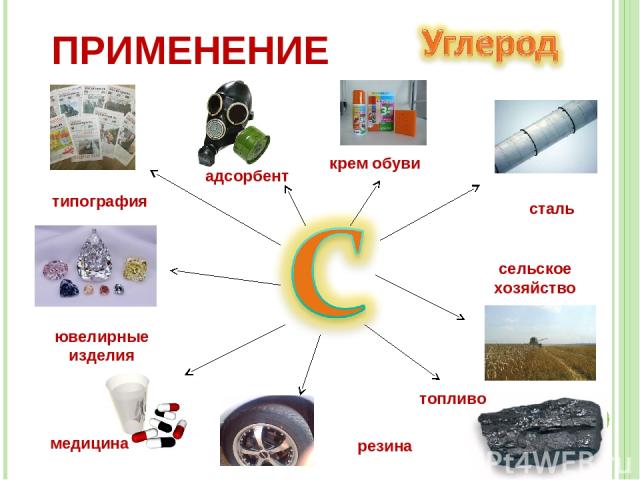
сталь сельское хозяйство топливо медицина типография ювелирные изделия адсорбент резина крем обуви ПРИМЕНЕНИЕ

ЦЕЛИ УРОКА: – установить строение атома углерода по его положению в ПС; – изучить аллотропные модификации углерода; – изучить химические свойства и применение углерода; – изучить строение, свойства, получение и применение оксидов углерода II, IV; – изучить строение, свойства и применение угольной кислоты.

Учитывая положение углерода в Периодической системе, ответьте на вопросы: Каков химический знак углерода? Каков атомный номер и заряд ядра? Какова атомная масса? Сколько протонов в ядре атома? Сколько нейтронов в ядре атома? Сколько электронов в атоме углерода? Сколько валентных электронов? Чему равна низшая степень окисления? Чему равна высшая степень окисления? За каждый правильный ответ – 1 балл. Алгоритм ответов Учебный модуль №1

1) С 2) 6, +6 3) Ar(C) = 12 4) 6 5) 12 – 6 = 6 6) 6, 7) 4, 8) II 9) IV Учебный модуль №1 (алгоритм ответа)
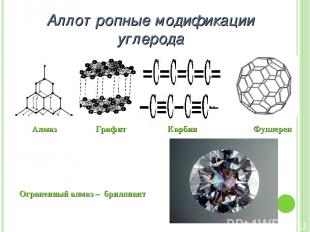
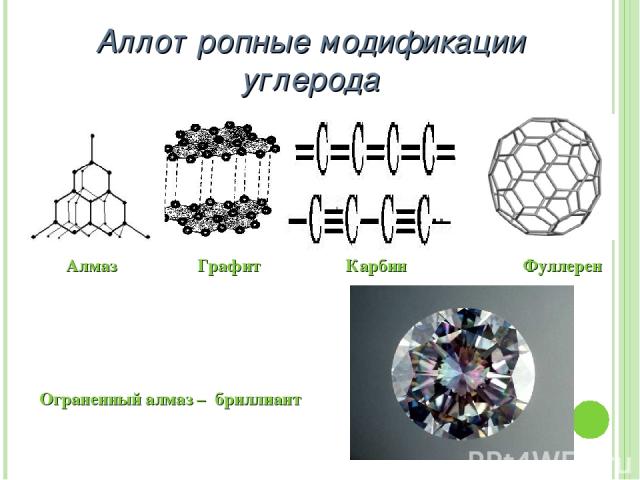
Аллотропные модификации углерода Алмаз Графит Карбин Фуллерен Ограненный алмаз – бриллиант
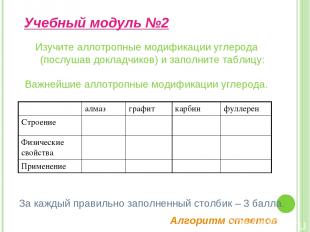
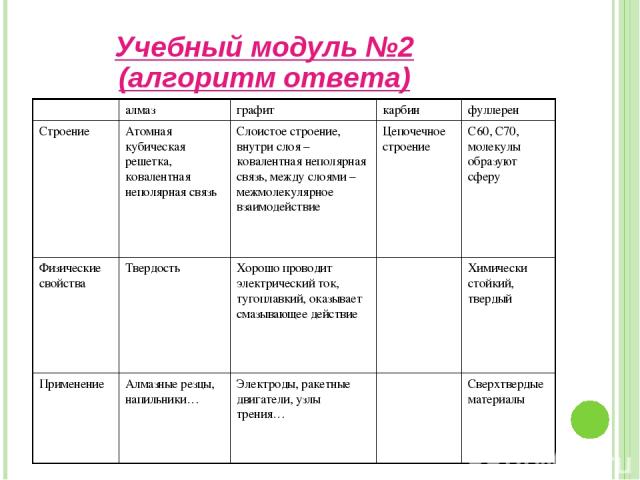
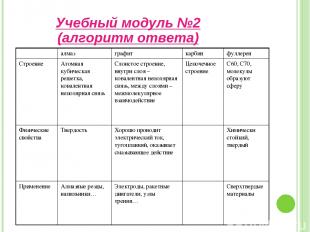
Изучите аллотропные модификации углерода (послушав докладчиков) и заполните таблицу: Важнейшие аллотропные модификации углерода. Учебный модуль №2 За каждый правильно заполненный столбик – 3 балла. Алгоритм ответов
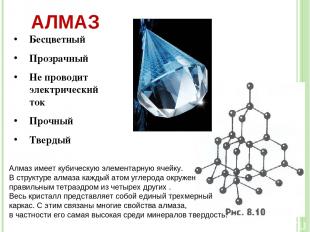
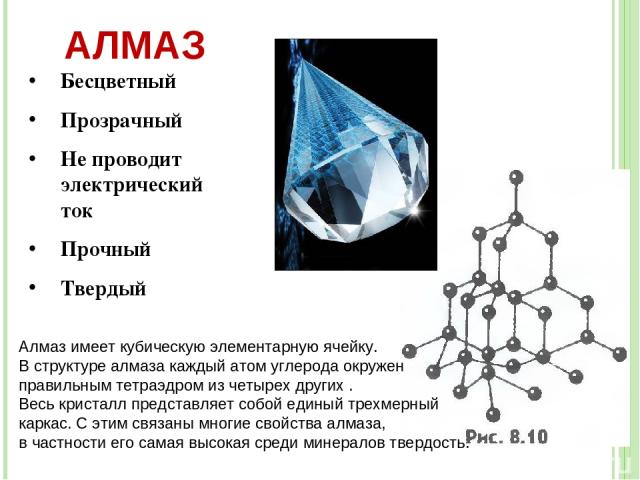
АЛМАЗ Бесцветный Прозрачный Не проводит электрический ток Прочный Твердый Алмаз имеет кубическую элементарную ячейку. В структуре алмаза каждый атом углерода окружен правильным тетраэдром из четырех других . Весь кристалл представляет собой единый трехмерный каркас. С этим связаны многие свойства алмаза, в частности его самая высокая среди минералов твердость.

ГРАФИТ Темно-серый Непрозрачный Проводит электрический ток Мягкий Металлический блеск Оставляет след на бумаге Жирный на ощупь Кристаллическая решетка графита состоит из бесконечных плоских параллельных слоев, образованных из шестичленных колец (циклов). Между слоями существуют слабые связи, поэтому они легко отделяются друг от друга. Этим объясняется малая механическая прочность графита.

Карбин представляет собой мелкокристаллический порошок чёрного цвета, обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу. Карбин — линейный полимер углерода. КАРБИН

Фуллере ны— молекулярные соединения,представляющие собой выпуклые замкнутые многогранники, составленные из чётного числа трёхкоординированных атомов углерода. Используют для изготовления полупроводников, антиоксидантов и биофармпрепаратов, в качестве добавок при изготовлении искусственных алмазов. ФУЛЛЕРЕН
Учебный модуль №2 (алгоритм ответа)
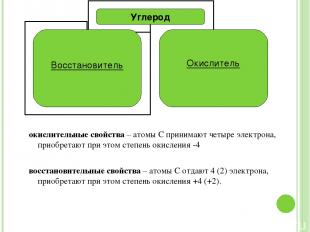
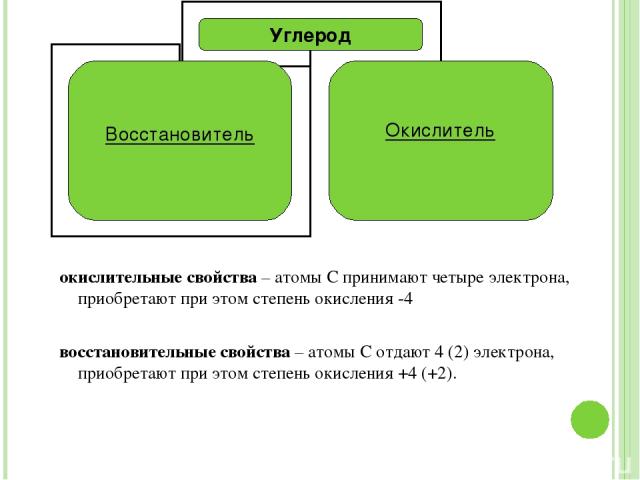
окислительные свойства – атомы С принимают четыре электрона, приобретают при этом степень окисления -4 восстановительные свойства – атомы С отдают 4 (2) электрона, приобретают при этом степень окисления +4 (+2).

Окислительные свойства 1.При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ: С + O2 = CO2 При недостатке кислорода образуется оксид углерода (II), или угарный газ: 2С + О2 = 2СО 2. С водородом углерод соединяется только при высоких температурах и в присутствии катализаторов. С + 2H2 = CH4 3. Углерод взаимодействует при нагревании с серой и фтором, в электрической дуге с азотом: С + 2S = CS2 С + 2F2 = CF4 2С + N2 = (CN)2

Восстановительные свойства 1. При нагревании с водяным паром он вытесняет из воды водород: Н2O + С = СО + Н2 2. При нагревании углерода с оксидом углерода (IV) образуется угарный газ: С + СО2 = 2СО 3. Углерод восстанавливает многие металлы из их оксидов: 2Fe2O3 + 3С = 4Fe + 3CO2 4. С металлами или их оксидами углерод образует карбиды: CaO + 3C = CaC2 + СО 4Al + 3C = Al4C3

C + O2 = C + O2 = C + H2 = C + Ca = C + Al = C + CuO = C + FeO = C + H2O = Закончите уравнения реакций Учебный модуль №3 За каждую реакцию – 1 балл. Алгоритм ответов

2C + O2 = 2СО C + O2 = СО2 C + 2H2 = СН4 2C + Ca = СаС2 4C + 3Al = Аl3С4 C + CuO =Сu + CO. C + FeO = Fe + CO, C + H2O = CO + H2, Закончите уравнения реакций Учебный модуль №3 (алгоритм ответа)

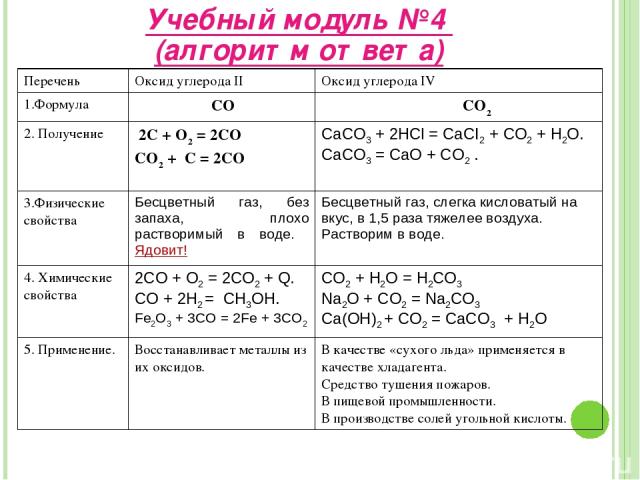
Заполните таблицу Учебный модуль №4 За каждую правильно заполненную строку – 2 балла. Алгоритм ответов Признак сравнения Оксид углерода II Оксид углерода IV 1. Формула 2. Получение 3. Физические свойства 4. Химические свойства 5. Применение

2CO + O2 = 2CO2 + Q Fe2O3 + 3CO = 2Fe + 3CO2 CO + 2H2 = CH3OH Угарный газ - СО СО – угарный газ. Оксид углерода ( +2) – бесцветный газ, без запаха, плохо растворимый в воде. Ядовит! Физические свойства Химические свойства Получение 2C + O2 = 2CO CO2 + C =2CO

CO2 + H2O = H2CO3 Na2O + CO2 = Na2CO3 Ca(OH)2 + CO2 = CaCO3 + H2O Углекислый газ – СО2 СО2 - оксид углерода (+4) , углекислый газ– бесцветный газ, слегка кисловатый на вкус, в 1,5 раза тяжелее воздуха. Растворим в воде. Физические свойства Химические свойства Получение CaCO3 + 2HCl = CaCI2 + CO2 + H2O CaCO3 = CaO + CO2 Вернуться к заданию
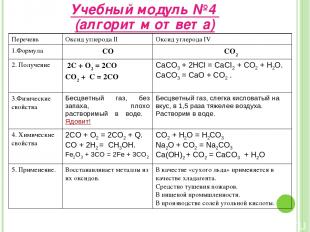
Учебный модуль №4 (алгоритм ответа) Перечень Оксид углерода II Оксид углерода IV 1.Формула СО СО2 2. Получение 2С + О2 = 2СО СО2 + С = 2СО CaCO3 + 2HCl = CaCI2 + CO2 + H2O. CaCO3 = CaO + CO2 . 3.Физические свойства Бесцветный газ, без запаха, плохо растворимый в воде. Ядовит! Бесцветный газ, слегка кисловатый на вкус, в 1,5 раза тяжелее воздуха. Растворим в воде. 4. Химические свойства 2CO + O2 = 2CO2 + Q. CO + 2H2 = CH3OH. Fe2O3 + 3CO = 2Fe + 3CO2 CO2 + H2O = H2CO3 Na2O + CO2 = Na2CO3 Ca(OH)2 + CO2 = CaCO3 + H2O 5. Применение. Восстанавливает металлы из их оксидов. В качестве «сухого льда» применяется в качестве хладагента. Средство тушения пожаров. В пищевой промышленности. В производстве солей угольной кислоты.

Угольная кислота H2CO3 Угольная кислота — слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
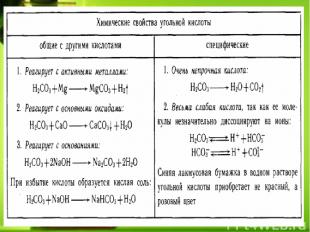

Применение Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода). Угольную кислоту мы в чистом виде употребляем в газированных напитках. При открытии крышки газированного напитка раздается шипение. При данном явлении угольная кислота разлагается на углекислый газ и воду)

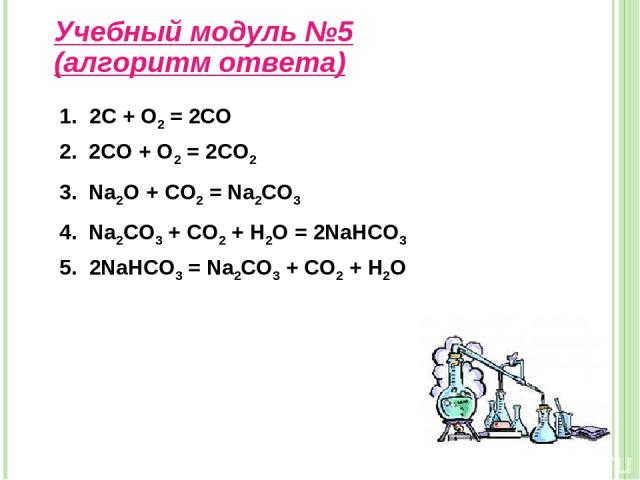
Осуществите превращение Учебный модуль №5 За каждую правильную реакцию – 1 балл. С→СО→СО2 →Na2CO3→ NaHCO3→CO2 Алгоритм ответов
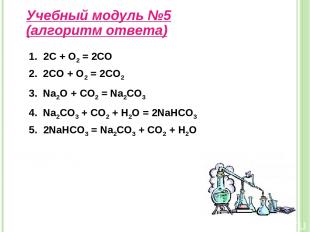
Учебный модуль №5 (алгоритм ответа) 1. 2С + О2 = 2СО 2. 2CO + O2 = 2CO2 3. Na2O + CO2 = Na2CO3 4. Na2CO3 + CO2 + H2O = 2NaHCO3 5. 2NaHCO3 = Na2CO3 + CO2 + H2O

Подведение итогов урока. Оцените свою работу на уроке (подсчитайте количество баллов, набранных за выполнение учебных модудей №1 -5): – 39 – 41 баллов – 36–38 баллов – 30–35 балла Меньше 30 баллов – неудовлетворительно. Выберите домашнее задание в зависимости от набранных баллов и запишите в дневник.

Домашнее задание. – §31,32 упр. № 6 стр.172, упр. № 6(а) стр. 178 – §31,32 упр. № 8 стр.172, упр. № 7 стр. 178 – §31,32 упр. № 2 стр.172, упр. № 6(б) стр. 178 “2” – §31,32 упр. № 4 стр.172, упр. № 4 стр. 177