Презентация на тему: Углерод, соединения углерода

«Углерод и его соединения»

Цель занятия: обобщение, систематизация и углубление знаний по теме «Углерод и его соединения»

Вопросник: Элементы, содержащиеся в живых организмах. Аллотропные модификации углерода: алмаз и графит. Значение углерода. Белки и нуклеиновые кислоты: строение и функции. Применение соединений углерода. Круговорот углерода в природе. Жесткость воды и способы ее устранения. Углерод, его соединения и здоровье.

Иллюстративный материал для ответов учащихся (в форме мультимедийной презентации)

К вопросу № 1 Элементы, встречающиеся в живых организмах Главные элементы органических молекул Ионы Микроэлементы Н водород С углерод N азот О кислород Р фосфор S сера Na+ натрий Mg2+ магний Cl- хлор Ca2+ кальций Mn марганец Fe железо Co кобальт Cu медь Zn цинк B бор Al алюминий Si кремний V ванадий Mo молибден I йод
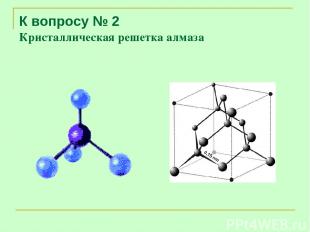
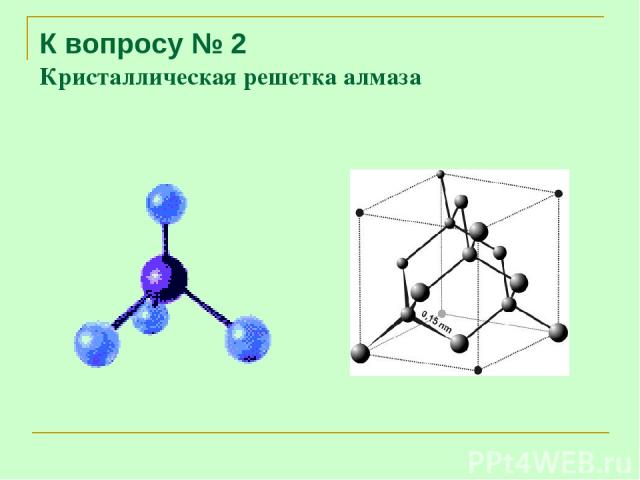
К вопросу № 2 Кристаллическая решетка алмаза

К вопросу № 2 Изделия из алмаза Буры и сверла

К вопросу № 2 Изделия из алмаза
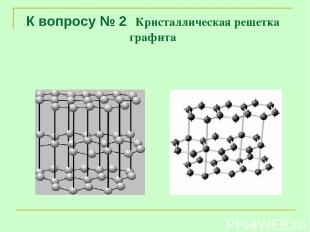
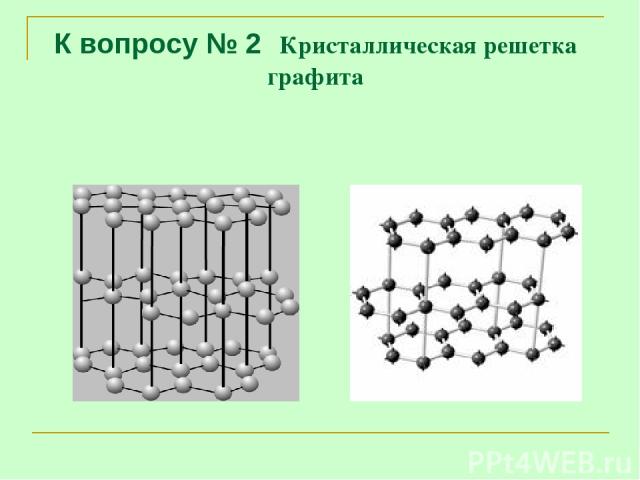
К вопросу № 2 Кристаллическая решетка графита

К вопросу № 2 Изделия из графита Активированный уголь, противогаз, электроды, карандаши

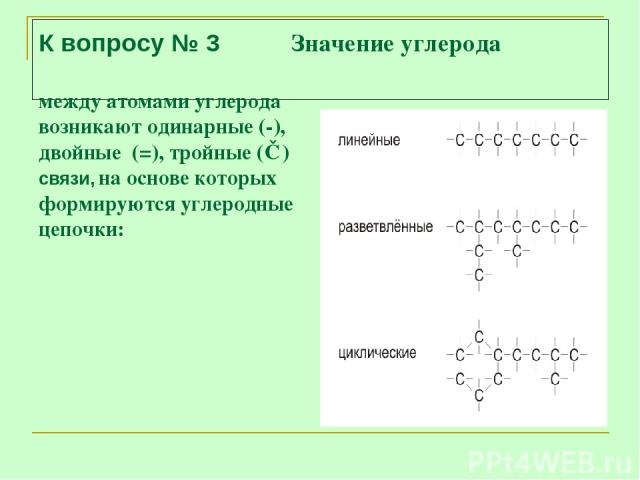
К вопросу № 3 Значение углерода между атомами углерода возникают одинарные (-), двойные (=), тройные (≡) связи, на основе которых формируются углеродные цепочки:
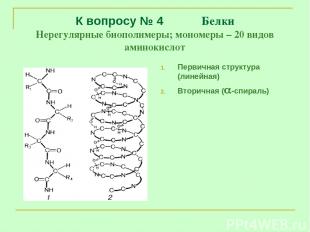
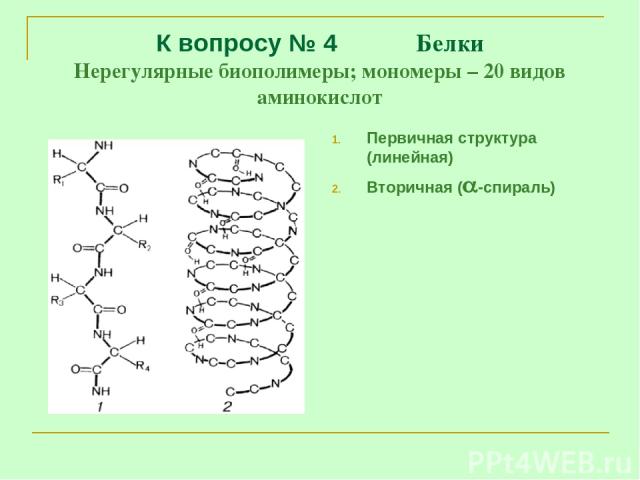
К вопросу № 4 Белки Нерегулярные биополимеры; мономеры – 20 видов аминокислот Первичная структура (линейная) Вторичная ( -спираль)
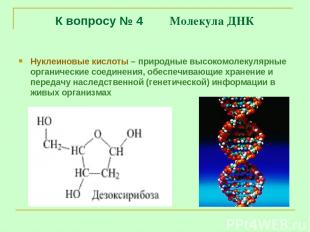
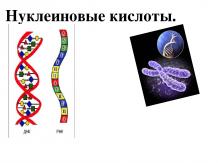
К вопросу № 4 Молекула ДНК Нуклеиновые кислоты – природные высокомолекулярные органические соединения, обеспечивающие хранение и передачу наследственной (генетической) информации в живых организмах

К вопросу № 5 Применение соединений углерода: углекислый газ создание «дыма» на сцене; тушение пожаров

К вопросу № 5 Применение соединений углерода: углекислый газ «сухой лед» для хранения пищевых продуктов; изготовление шипучих напитков
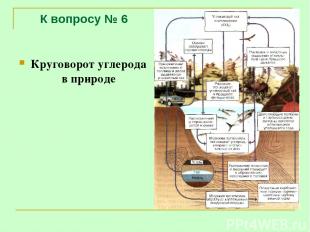
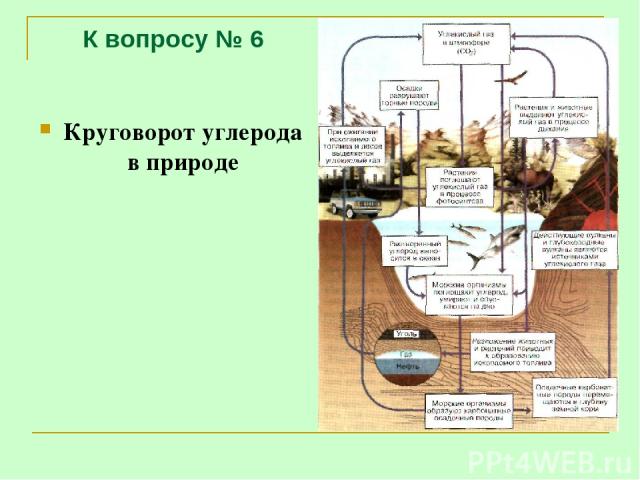
К вопросу № 6 Круговорот углерода в природе

К вопросу № 6 Парниковый эффект

К вопросу № 6 Парниковый эффект
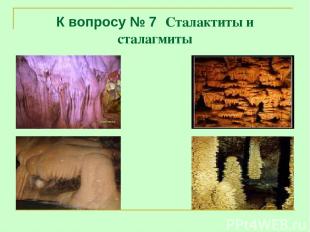
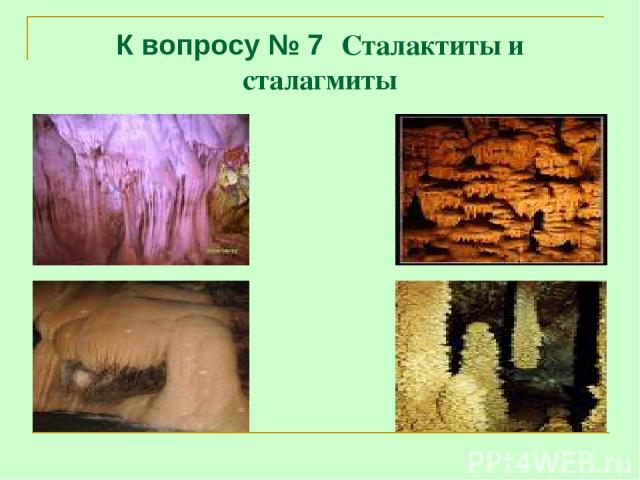
К вопросу № 7 Сталактиты и сталагмиты

К вопросу № 7 Последствия использования жесткой воды

К вопросу № 7 Устранение жесткости воды Гидрокарбонатной (временной): А) кипячение воды: Са(НСО3)2→СаСО3 ↓+ Н2О + СО2 Mg(НСО3)2→MgСО3 ↓+ Н2О + СО2 Б) добавление гашеной извести: Са(НСО3)2 + Са(ОН)2 → 2СаСО3 ↓+ Н2О Mg(НСО3)2+ 2Са(ОН)2→ Mg(ОН)2↓+2СаСО3↓ +2 Н2О

К вопросу № 7 Устранение жесткости воды Постоянной (некарбонатной): А) добавление соды: CaCL2 + Na2CO3 → CaCO3 ↓+ 2NaCL MgSO4 + Na2CO3 → MgCO3 ↓+ Na2SO4 Б) вымораживание льда, В) перегонка, Г) катионообменный.
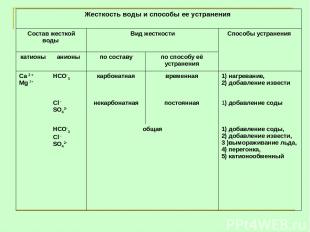
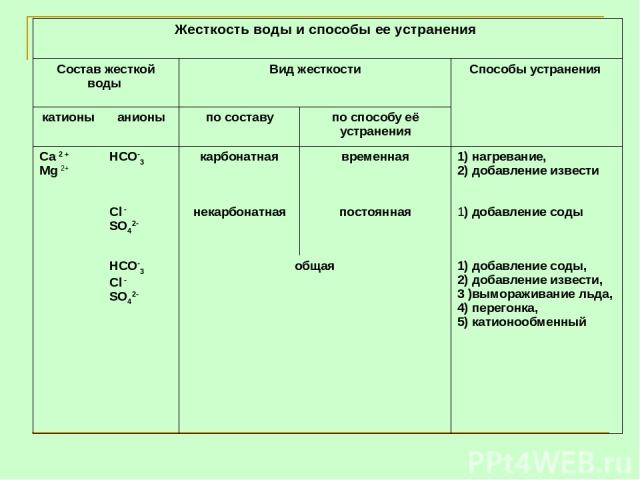
Жесткость воды и способы ее устранения Состав жесткой воды Вид жесткости Способы устранения катионы анионы по составу по способу её устранения Са 2 + Mg 2+ НСО-3 карбонатная временная 1) нагревание, 2) добавление извести Сl - SO42- некарбонатная постоянная 1) добавление соды НСО-3 Сl - SO42- общая 1) добавление соды, 2) добавление извести, 3 )вымораживание льда, 4) перегонка, 5) катионообменный
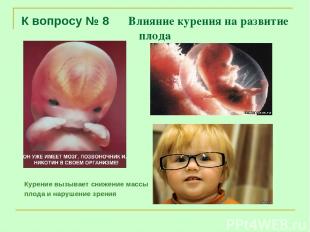
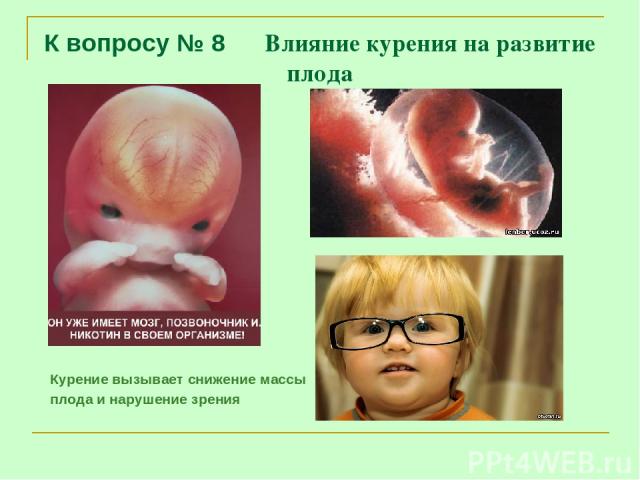
К вопросу № 8 Влияние курения на развитие плода Курение вызывает снижение массы плода и нарушение зрения
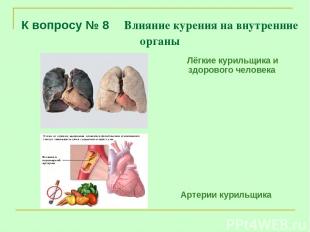
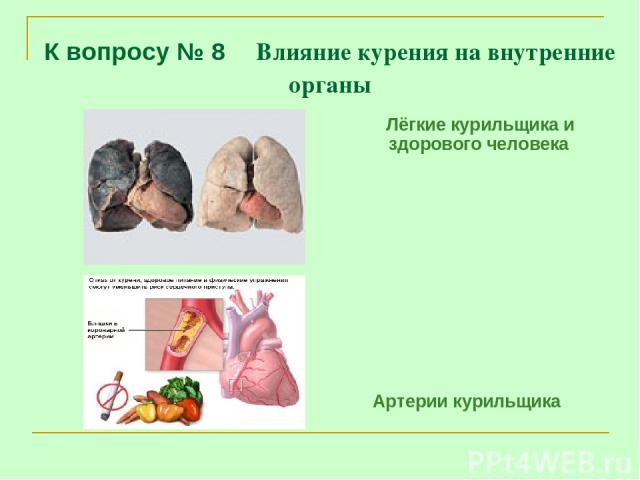
К вопросу № 8 Влияние курения на внутренние органы Лёгкие курильщика и здорового человека Артерии курильщика

Алгоритм работы в парах сменного состава: Каждый партнер получает листок учета и карточку с вопросом. Первый партнер рассказывает второму партнеру ответ на вопрос своей карточки, затем второй партнер излагает ответ на вопрос своей карточки. В листках учета делают отметку о выполненной работе (полный ответ- 2 балла, неполный ответ -1 балл, нет правильного ответа – 0 баллов), обмениваются карточками и переходят в другую пару. В новой паре работают по такому же алгоритму.

Правила работы в парах: Говорить вполголоса, но не шепотом. Готов сменить партнера - поднимай руку высоко, хочешь задать вопрос учителю – поднимай руку как обычно. Если не можешь сменить партнера – выполни задание в «свободную минутку». Не перебивай партнера в ходе его высказывания, как бы тебе не хотелось высказаться самому (умей слушать). Разговор в паре должен быть только о предмете задания. Чтобы научиться делать быстро – научись делать медленно. Поблагодарите друг друга после окончания работы.

Перевод баллов в оценку: 12-16 баллов – «5», 8 -11 баллов – «4», 3 -7 баллов – «3».

Рефлексия Что было нового на уроке для каждого из вас? Что было главным для вас на уроке? Что было самым интересным? Какие пробелы в знаниях по данной теме удалось вам ликвидировать?