Презентация на тему: Классы органических веществ

Предмет органической химии. Классификация органических веществ

План 1. Определение предмета орг. химии. 2. Признаки органических веществ. 3. Особенности углерода. 4. Виды ковалентной связи, тип гибридизации электронных облаков. 5. Классификация органических веществ. 6. Круговорот углерода в природе.

1. Органическая химия – наука о соединениях углерода, их свойствах, строении и превращениях. 2. Признаки органических веществ: а) горение с образованием углекислого газа и воды; б) разложение при нагревания с выделением углерода (сажа); в) почти все имеют молекулярную кристаллическую решетку.

3. В учебнике «Основы химии» Д.И.Менделеев писал: «Способность атомов углерода соединяться между собой и давать сложные частицы проявляется во всех углеродистых соединениях. Ни в одном из элементов способности к усложнению не развито в такой степени, как в углероде. Ни одна пара элементов не дает столь много соединений, как углерод с водородом.» Ученые А. Кекуле и А. Купер установили, что углерод всегда четырехвалентен и способен образовывать углерод - углеродные цепи. Кроме этого, строение атомов углерода позволяет образовывать простые и кратные связи.

В органических веществах существуют, в основном, ковалентные химические связи: а) А. + .А = А:А б) А: + :А = А: :А Ковалентные связи делятся на сигма(σ) -связь и пи(π)-связь. а) Если наибольшая электрнная плотность находится на прямой между ядрами атомов – это сигма(σ)-связь.

б) Если наибольшая электронная плотность находится под углом к ядрам атомов, такая ковалентная связь называется пи(π) - связью. ПРИМЕЧАНИЕ: При наличии между двумя атомами ХЭ 2-х или 3-х химических связей одна из них будет сигма-связь, а остальные - пи-связи.

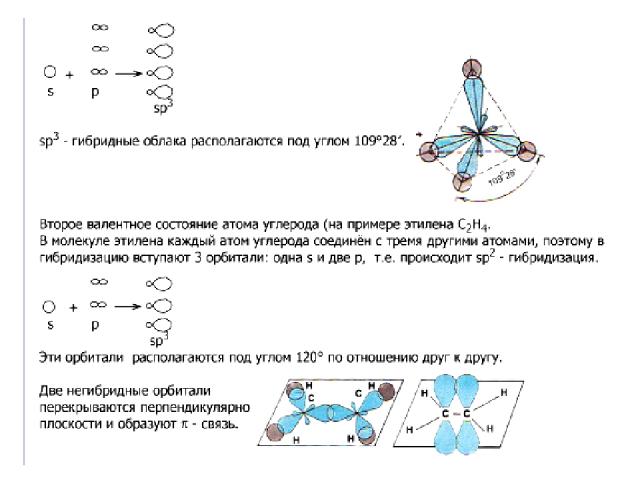
В образовании сигма (σ)-связи участвуют гибридизованные электронные облака. Гибридизация – это выравнивание электронных облаков по форме, величине и энергии. Существует три типа гибридизации: а) sp3 – гибридизация; б) sp2 – гибридизация; в) sp – гибридизация. В органических веществах гибридизации подвергаются электронные облака атомов углерода. От типа гибридизации зависит строение органических веществ, а, следовательно, свойства.
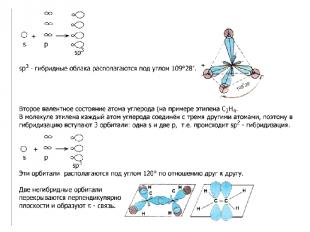

Органические соединения делятся на три большие группы: 1. Углеводороды. 2. Кислородсодержащие. 3. Азотсодержащие. Классы углеводородов отличаются типом гибридизации и числом пи - связей.

Кислородсодержащие органические вещества делятся на спирты, простые эфиры, альдегиды, карбоновые кислоты, сложные эфиры, углеводы и т. д.. Азотсодержащие: амины, аминокислоты, белки, нуклеиновые кислоты. 6 CO2 + 6 H2 O = C6 H12 О6 + 6 О2 Фотосинтез

Ковалентные связи, образующие органичес- кие вещества, могут разрушаться под дейст- вием природных факторов, поэтому углерод совершает непрерывный круговорот в при- роде. Д/З: конспект, №1, з.6 (5), вопросы 2, 3, 4.

План урока 1.Письменный опрос: а)В чем заключается виталистическая теория Берцелиуса? Крах вит. теории. б)Перечислить особенности орг. соед-й. в)Строение атома углерода. Определение понятия гибридизации. г) Типы ковалентной связи. Изобразить схемы образования. д)Виды гибридизации.

2.Основные положения ТХС. 3.Понятия валентности, гомологии, изомерии. 4.Структурные формулы орг. соединений. Д/З №2, составить формулы двух гомологов и двух изомеров к С6Н14(гексан) Подготовиться к зачету «ТХС, гомологи, изомеры».


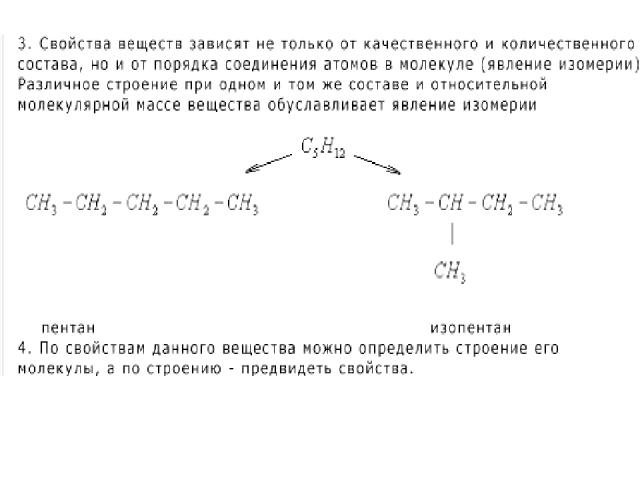
Атомы, соединенные в молекулу, взаимно влияют друг на друга. Наибольшее влияние оказывают атомы, соединенные непосредственно. Структурные формулы показывают порядок соединения атомов в молекуле. Следовательно, для каждого вещества существует только одна формула строения.

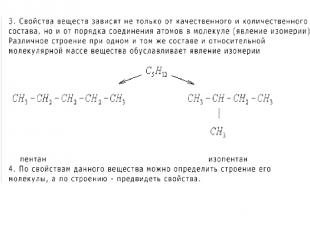
1.Валентность – это свойство атомов ХЭ образовывать определенное число химических связей. 2.Вещества, которые имеют одинаковый качественный состав и сходное строение, но отличаются друг от друга на группу атомов -СН2 - (одну или несколько), называются гомологами.

Гомологический ряд метана: СН4, С2Н6, С3Н8, С4Н8 Метан Этан Пропан Бутан Гомологический ряд этилена: С2Н4, С3Н6 С4Н8 С5Н10 Этен Пропен Бутен Пентен Гомологический ряд ацетилена: С2Н2, С3Н4 С4Н6 С5Н8 Этин Пропин Бутин Пентин

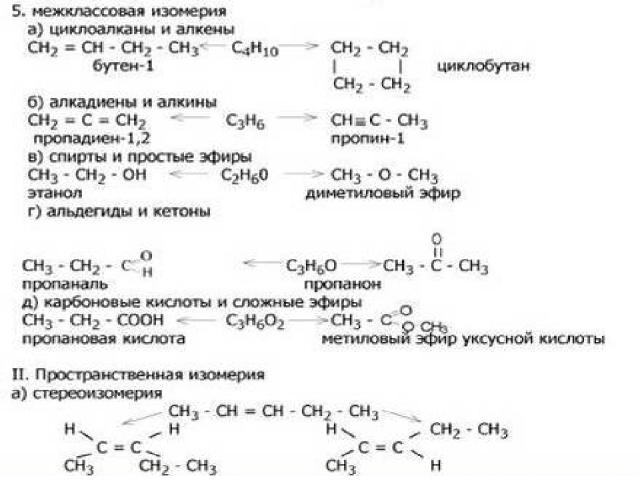
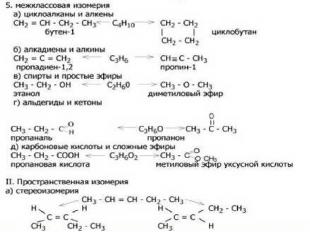
3.Изомеры – это в – ва, которые имеют одинаковую молекулярную формулу (качественный и количественный состав), но разное строение.


Урок №3 Предельные углеводороды (алканы, парафины )

План 1.Определение алканов. 2.Строение молекулы: а)первое валентное состояние углерода б)пространственное строение молекул в)изомерия и номенклатура алканов 3.Физические свойства. 4.Зачет по теме«ТХС,гомологи, изомеры»

Предельные УВ (алканы, парафины) - это соединения, в которых химические связи углерода до предела насыщены атомами водорода. С5Н12, С6Н14 С7Н16 С8Н18 Пентан Гексан Гептан Октан С9Н20 – нонан С10Н22 - декан СnH2n+2 – общая формула парафинов. Гомологический ряд метана: СН4, С2Н6, С3Н8, С4Н8 Метан Этан Пропан Бутан

В молекулах алканов существует малополярная (s – p) и неполярная (р – р) сигма – связь. Эта связь очень прочная и малополяризуемая, поэтому данные УВ являются устойчивыми, на них не действуют при обычных условиях р – ры кислот, щелочей и окислители. (Pаrаfinоs – пассивный (греч.)).
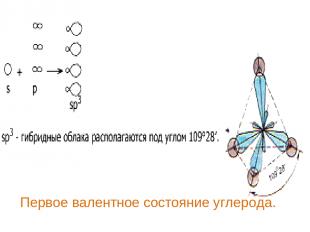
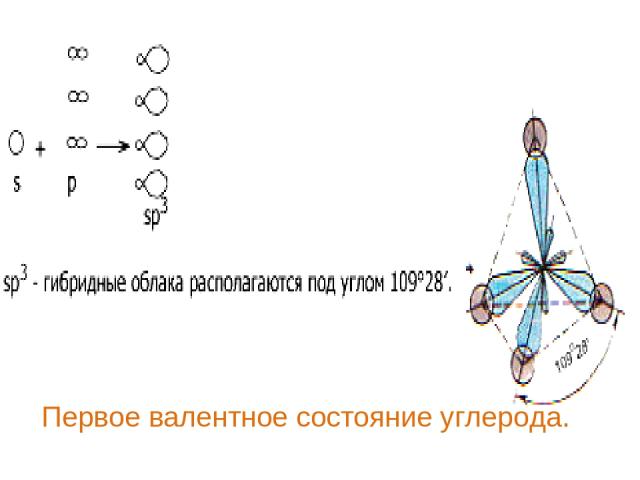
Первое валентное состояние углерода.

В алканах атомы углерода находятся в sp3- гибридизации. Это первое валентное состояние атомов углерода. Гибридизованные электронные облака взаимно отталкиваются и образуют угол 109о 28/ . Длина С – С связи составляет 0,154 нм. Вследствие этого молекулы приобретают тетраэдрическое строение и в пространстве имеют вид зигзага (если С > 3).

В ряду алканов существует изомерия по разветвлению углеродного скелета. В р – х изомеризации УВ нормального строения превращаются в разветвленные. CH3 CH3- CH2- CH2-CH2-CH3 -> H3C - C - CH3 н - пентан СН3 2,2 – диметилпропан Катализатор реакции – Al Cl3, to . **Составьте формулу 2,3 – диметилбутана.