Презентация на тему: Классификация неорганических веществ. Оксиды

Классификация неорганических веществ. Оксиды. Автор: Калитина Тамара Михайловна Место работы: МОУ СОШ №3 с.Александров-Гай Саратовской области Должность: учитель экологии, биологии, химии. Дополнительные сведения: сайт http://kalitina.okis.ru/ Мини-сайт http://www.nsportal.ru/kalitina-tamara-mikhailovna

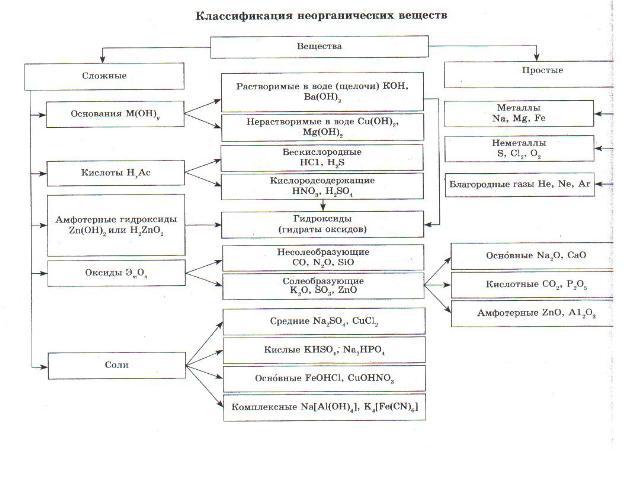
ОКСИДЫ Оксиды- бинарные соединения с кислородом в степени окисления (-2). Общая формула оксидов: ЭmOn где m число атомов элемента Э, а n – число атомов кислорода.
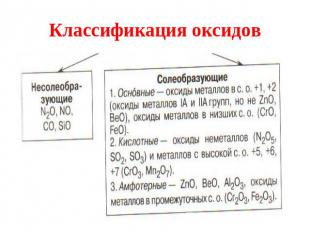
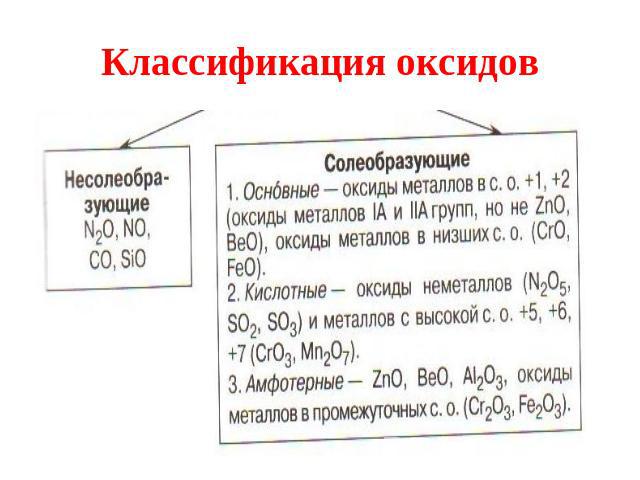
Классификация оксидов

Несолеобразующие оксиды Несолеебразующими называются такие оксиды, которые не взаимодействуют ни со щелочами, ни с кислотами и не образуют солей. Их немного, в их состав входят неметаллы.

Солеобразующие Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду. Среди солеобразующих оксидов различают оксиды: основные, кислотные, амфотерные.

Основные оксиды Основные оксиды - это такие оксиды, которым соответствуют основания. Например: СаО - Са(ОН)2 Na2O - NaOH

Кислотные оксиды Кислотные оксиды - это такие оксиды, которым соответствуют кислоты. Это оксиды неметаллов: N2O 5 соответствует Н NO 3 , SO3 – H2SO4 А так же оксиды металлов с большим значением степеней окисления: Сr2 O3 - H2 Сr O4 Mn2O7 - H MnO4

Амфотерные оксиды Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Это ZnO, Al2O3, Cr2O3, V2O3 Амфотерные оксиды с водой непосредственно не соединяются.

Источники информации ЕГЭ. Химия.:универсальный справочник/О.В.Мешкова.- М.: Эксмо, 2010.- 368 с. Химия/ О.С. Габриелян, И.Г.Остроумов, С.А.Сладков. –М.: Дрофа, 2011. – 304.с.