Презентация на тему: Гибридизация атомов углерода

Валентные состояния атома углерода. Гибридизация.
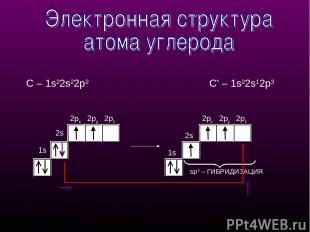
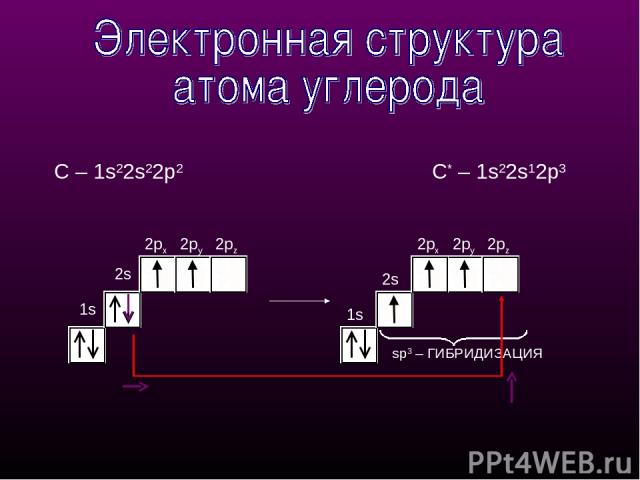
1s 2px 2py 1s 2px 2py 2pz sp3 – ГИБРИДИЗАЦИЯ 2s 2pz С – 1s22s22p2 С* – 1s22s12p3


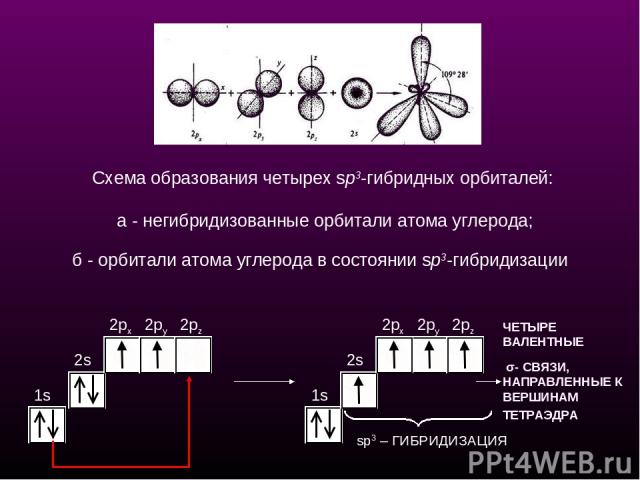
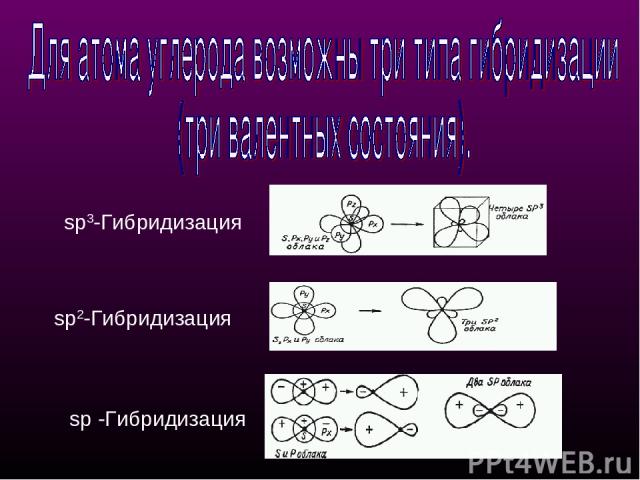
sр3-Гибридизация - смешение одной 2s- и трех 2р-орбиталей. Все четыре гибридные орбитали строго ориентированы в пространстве под углом 109°28' друг к другу, создавая утолщенными "лепестками" геометрическую фигуру - тетраэдр Поэтому sp3-гибридизованный атом углерода часто называют "тетраэдрическим". Состояние углеродного атома с sp3-гибридными орбиталями (первое валентное состояние) характерно для предельных углеводородов - алканов. sp3 - тетраэдрическое строение sр3-Гибридизация
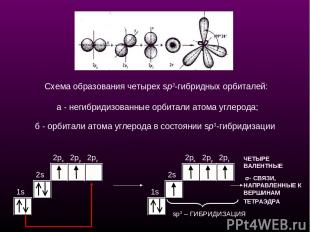
1s 2s 2px 2py 2pz 1s 2px 2py 2pz ЧЕТЫРЕ ВАЛЕНТНЫЕ σ- СВЯЗИ, НАПРАВЛЕННЫЕ К ВЕРШИНАМ ТЕТРАЭДРА sp3 – ГИБРИДИЗАЦИЯ Схема образования четырех sp3-гибридных орбиталей: а - негибридизованные орбитали атома углерода; б - орбитали атома углерода в состоянии sp3-гибридизации
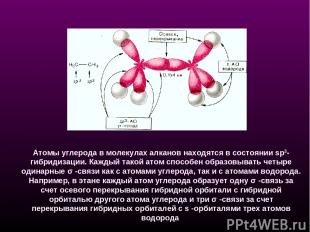
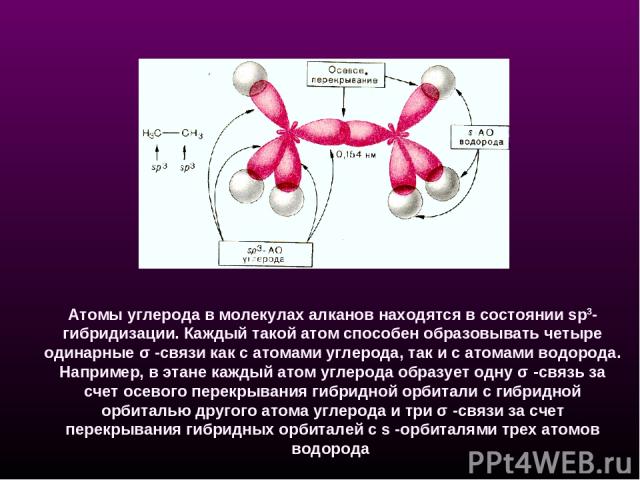
Атомы углерода в молекулах алканов находятся в состоянии sp3-гибридизации. Каждый такой атом способен образовывать четыре одинарные σ -связи как с атомами углерода, так и с атомами водорода. Например, в этане каждый атом углерода образует одну σ -связь за счет осевого перекрывания гибридной орбитали с гибридной орбиталью другого атома углерода и три σ -связи за счет перекрывания гибридных орбиталей с s -орбиталями трех атомов водорода
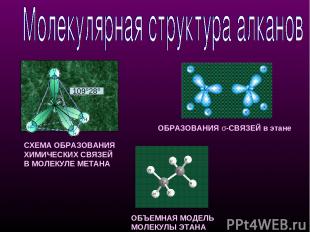
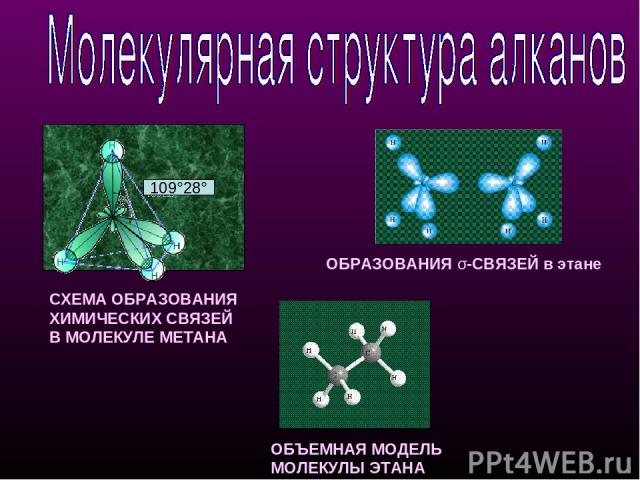
СХЕМА ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СВЯЗЕЙ В МОЛЕКУЛЕ МЕТАНА ОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ ЭТАНА ОБРАЗОВАНИЯ σ-СВЯЗЕЙ в этане
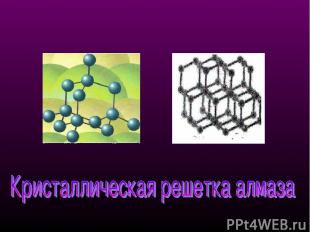
Кристаллическая структура алмаза
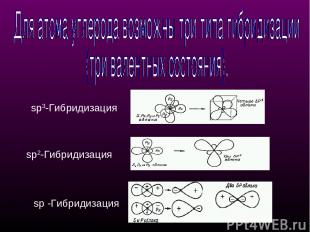
sр3-Гибридизация sр2-Гибридизация sр -Гибридизация

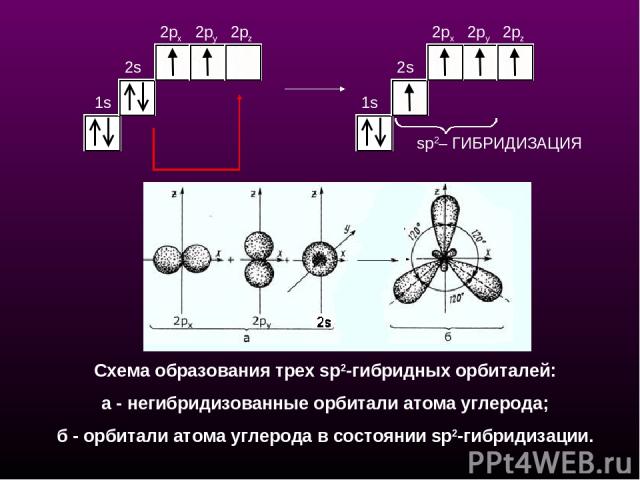
sр2-Гибридизация - смешение одной 2s- и двух 2р-орбиталей, одна 2p не гибридизована и перпендикулярна плоскости, в которой расположены три sp2-гибридные орбитали. Состояние атома углерода с sp2-гибридными орбиталями (второе валентное состояние) характерно для непредельных углеводородов ряда этилена - алкенов sp2 - плоскостное строение sр2-Гибридизация
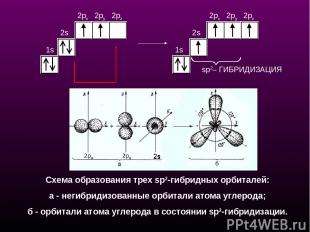
sp2– ГИБРИДИЗАЦИЯ 1s 2s 2px 2py 2pz 1s 2s 2px 2py 2pz Схема образования трех sр2-гибридных орбиталей: a - негибридизованные орбитали атома углерода; б - орбитали атома углерода в состоянии sp2-гибридизации.

sр2-Гибридизация
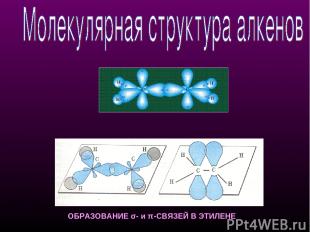
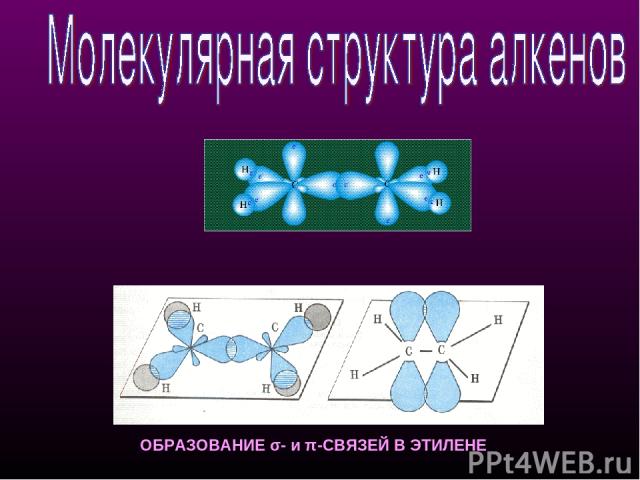
ОБРАЗОВАНИЕ σ- и π-СВЯЗЕЙ В ЭТИЛЕНЕ

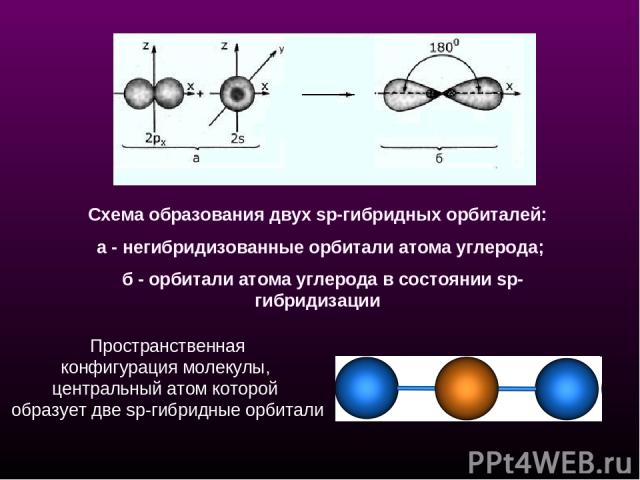
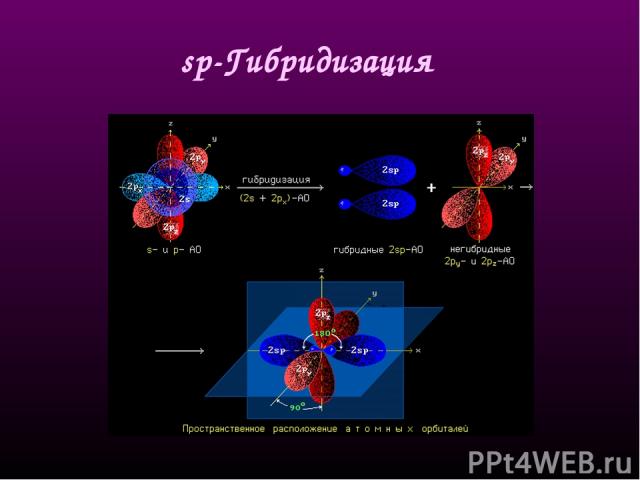
sр-Гибридизация - смешение одной 2s- и одной 2р-орбитали. Две гибридные орбитали расположены на одной прямой линии под углом 180° друг к другу. Остальные две негибридизованные 2р-орбитали расположены во взаимно перпендикулярных плоскостях. Состояние атома углерода с sp-гибридными орбиталями (третье валентное состояние) характерно для непредельных углеводородов ацетиленового ряда - алкинов. sp - линейное строение sр-Гибридизация
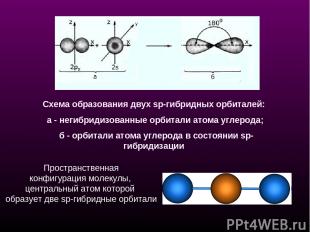
Схема образования двух sp-гибридных орбиталей: а - негибридизованные орбитали атома углерода; б - орбитали атома углерода в состоянии sp-гибридизации Пространственная конфигурация молекулы, центральный атом которой образует две sp-гибридные орбитали
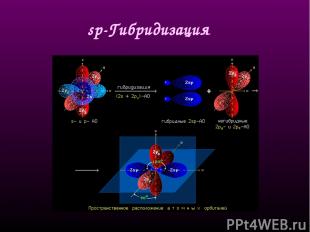
sр-Гибридизация
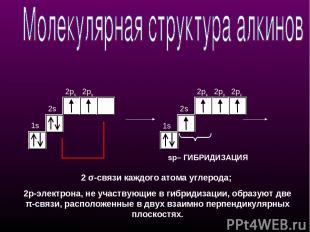
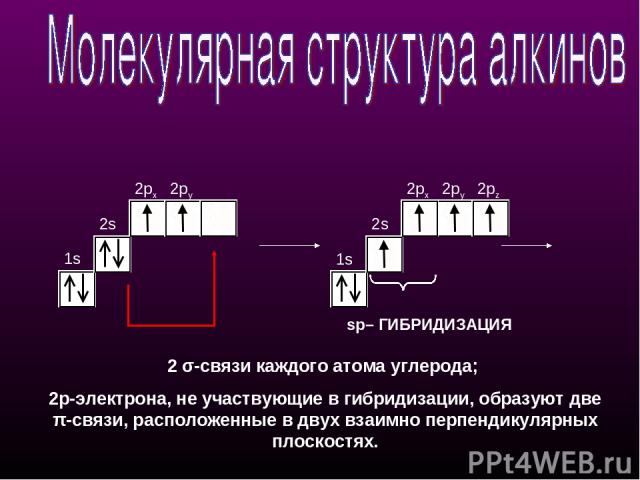
1s 2s 2px 2py 1s 2s 2px 2py 2pz sp– ГИБРИДИЗАЦИЯ 2 σ-связи каждого атома углерода; 2p-электрона, не участвующие в гибридизации, образуют две π-cвязи, расположенные в двух взаимно перпендикулярных плоскостях.
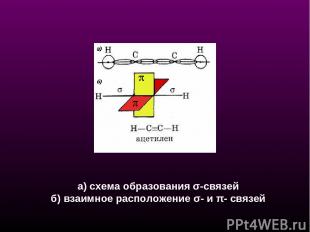
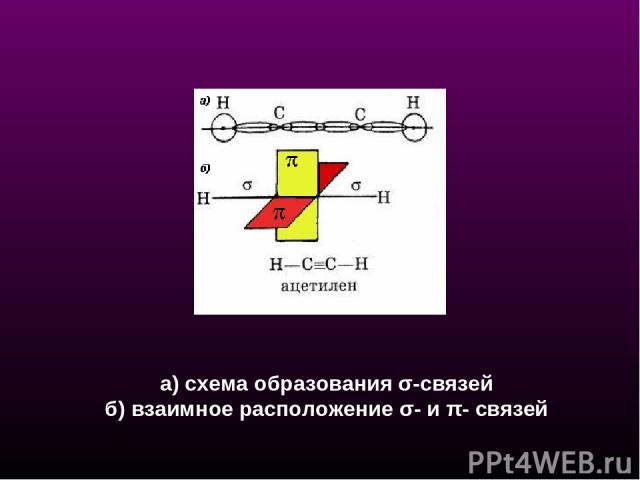
а) схема образования σ-связей б) взаимное расположение σ- и π- связей
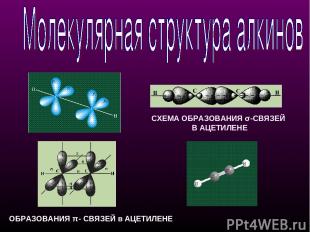
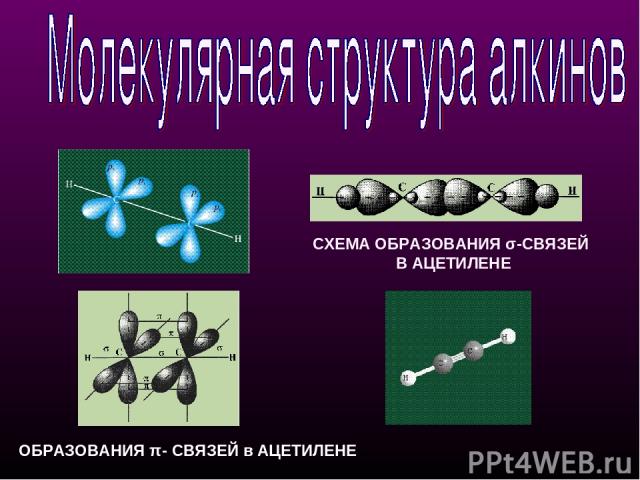
СХЕМА ОБРАЗОВАНИЯ σ-СВЯЗЕЙ В АЦЕТИЛЕНЕ ОБРАЗОВАНИЯ π- СВЯЗЕЙ в АЦЕТИЛЕНЕ

Достигли ли вы цели урока? В какой степени? Какие вопросы вызвали наибольшее затруднение? Оцените свою работу по предложенному тесту (Приложение1).