Презентация на тему: С о е д и н е н и я с е р ы

Учитель химии ГБОУ СОШ № 880 Город Москва Гершановская Евгения Владимировна


Сероводород - Н2S Сульфиды неметаллов – CS2, P2S3 Сульфиды металлов – Al2S3, K2S

Н2S Это - ядовитый газ со специфическим запахом, тяжелее воздуха и кислорода, растворимый в воде. При его растворении получается сероводородная кислота, являющаяся очень слабой, т.е. практически неэлектролитом Человек, попавший в атмосферу почти чистого сероводорода, внезапно, без всяких предварительных симптомов, теряет сознание и падает мертвым. Если вдыхать его даже в небольших количествах, и тогда смерть наступает быстро

Получение: водород + сера H2 + S ----H2S сульфид металла + сильная кислота ZnS + 2HCL---ZnCl2 + H2S конц. серная кислота + активный металл 8Na + 5H2SO4 -----4Na2SO4 + H2S + 4H2O Химические свойства: сгорание 2H2S + 3O2----2SO2 + 2H2O взаимодействие с некоторыми солями тяжелых металлов H2S + CuCl2---CuS + 2HCl взаимодействие с некоторыми неорганическими веществами по реакциям окисления-восстановления 2H2S + SO2---3S + 2H2О


Сернистый газ –SO2 Сернистая кислота –H2SO3 Сульфиты – K2SO3, BaSO3

СЕРНИСТЫЙ ГАЗ SO2 Оксид серы(lV) – сернистый газ, являющийся одним из главных загрязнителей атмосферного воздуха, кислотный оксид, очень хорошо растворимый в воде, образует слабую сернистую кислоту

Получение: разложение сернистой кислоты H2SO3 -----SO2 + H2O сгорание серы S + O2 ---SO2 обжиг сульфидов металлов 2ZnS + 3O2 ---2SO2 + 2H2O действие на сульфиты сильных кислот BaSO3 + 2HCl---BaCl2 + SO2 + H2O конц. серная кислота + неактивные металлы Cu + 2H2SO4 ---CuSO4 + SO2 + 2H2O

Химические свойства: с водой SO2 + H2O---H2SO3 с основными оксидами SO2 + BaO---BaSO3 с щелочами SO2 + 2KOH---K2SO3 + H2O с амфотерными оксидами и гидроксидами SO2 + ZnO---ZnSO3 3SO2 + 2AL(OH)3---AL2(SO3)3 + 3H2O

Составьте уравнения реакций оксида серы (Vl) с водой, оксидом натрия, гидроксидом кальция, оксидом алюминия. Назовите продукты реакции. Выполните задание: Проверьте себя: SO2 + H2O---H2SO3 SO2 + Na2O---Na2SO3 SO2 + Ca(OH)2---CaSO3 + H2O 3SO2 + Al2O3---Al2(SO3)3

Сернистая кислота – очень слабая, неустойчивая, легко разлагается на сернистый газ и воду (является аналогом угольной кислоты). Соли ее – сульфиты, растворимые из них только соли щелочных металлов. Сульфиты - это средние соли (CaSO3), но есть и кислые – гидросульфиты (NaHSO3). Сульфиты и гидросульфиты реагируют с сильными кислотами с образованием сернистого газа K2SO3 + 2HNO3---2KNO3 + SO2 + H2O

Серный ангидрид или оксид серы (Vl) –SO3 Серная кислота –H2SO4 Сульфаты – K2SO4, СaSO4

Оксид серы (Vl) – кислотный оксид, получается при окислении сернистого газа 2SO2 + O2---2SO3 Химические свойства подобные, как у сернистого газа При реакции с водой – SO3 + H2O---H2SO4 данный оксид дает сильную, двухосновную, кислородосодержащую кислоту, которая является высшим гидроксидом серы

Н2SO4 Два вида солей от серной кислоты: средние – сульфаты CaSO4 и кислые – гидросульфаты Ba(HSO4)2 Сульфаты металлов средней активности и неактивных металлов подвергаются гидролизу по катиону металла

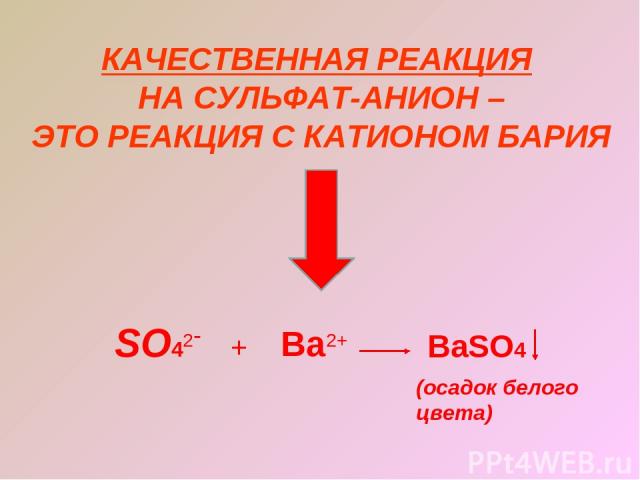
КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СУЛЬФАТ-АНИОН – ЭТО РЕАКЦИЯ С КАТИОНОМ БАРИЯ SO42- + Ba2+ BaSO4 (осадок белого цвета)

Н2SO4 Серная кислота - тяжелая бесцветная жидкость, которая бывает концентрированная и разбавленная, в зависимости от этого по-разному реагирует с металлами, а концентр. может реагировать и с неметаллами

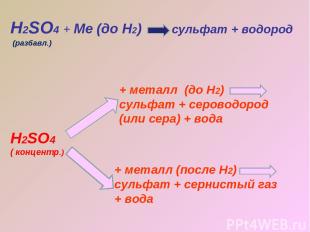
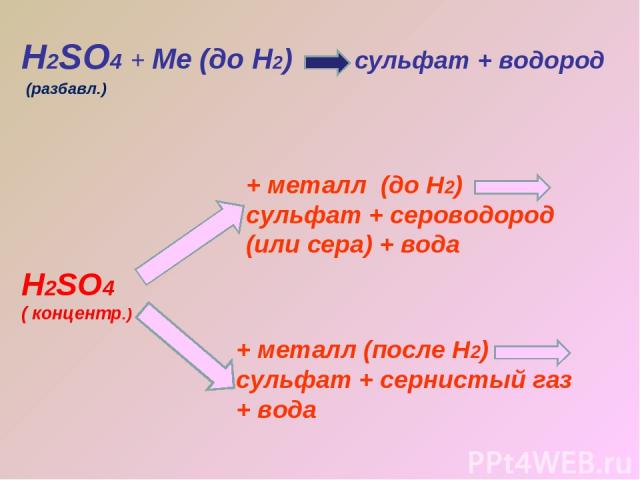
Н2SO4 + Ме (до Н2) сульфат + водород Н2SO4 ( концентр.) + металл (до Н2) сульфат + сероводород (или сера) + вода + металл (после Н2) сульфат + сернистый газ + вода (разбавл.)

Выполните задание по вариантам: 1 вариант – сернистый газ 2 вариант – серная кислота Вам даны 15 утверждений. Определите, какие из них истинные, а какие ложные

Это простое вещество Это соединение с высшей степенью окисления серы 3. Это сильный электролит 4. Это вещество в газообразном агрегатном состоянии 5. В нем ковалентная полярная связь 6. В нем молекулярная кристаллическая решетка 7. Оно легко реагирует с кислотами 8. Оно окислитель за счет серы 9. Оно реагирует с цинком 10. Оно хорошо растворяется в воде 11. Оно диэлектрик 12. Оно может окисляться 13. Оно реагирует с щелочами 14. Оно вступает в окислительно- восстановительные реакции 15. Из него можно получить кислоту

Сульфат меди(ll) Сульфат алюминия Сульфат бария Сульфат хрома(lll) Сульфат железа(ll) Сульфат кобальта Найдите соответствие между названием соли и ее изображением

Самостоятельная работа по вариантам:

1 вариант 2 вариант Составить о.в.р: Серная кислота разб. + натрий 2. Серная кислота разб. + медь 3. Серная кислота конц. + калий 4. Серная кислота конц. + медь 5. Сульфат меди(2) + цинк Серная кислота разб + магний 2. Серная кислота разб. + калий 3. Серная кислота конц. + серебро 4. Серная кислота конц. + магний 5. Сульфат железа(2) + литий Составить в ионном виде: Сульфит натрия + хлорная кислота Сульфид железа(2) + азотная кислота Сульфат натрия + хлорид бария Серная кислота + алюминий

http://moole.ru/uploads/posts/2010-05/1274898426_voda.jpg http://www.mv.org.ua/imn/2008/b1242.jpg http://im4-tub-ru.yandex.net/i?id=87899931-18-73&n=21 http://img1.liveinternet.ru/images/attach/c/6/89/469/89469533_3229571_vopros.jpg Ссылки на источники информации и изображений: Электронная энциклопедия ВИКИПЕДИЯ Учебник О.С.Габриелян – 9 класс Учебник Л.С.Гузей – 10 класс http://www.jewelgold.ru/wp-content/uploads/2010/11/barit.jpg http://www.made-from-india.com/gallery/2ada9b70125899ae2f0e5e70b250734f.jpg http://www.price-list.kiev.ua/img/pr_pic/622678764.jpg